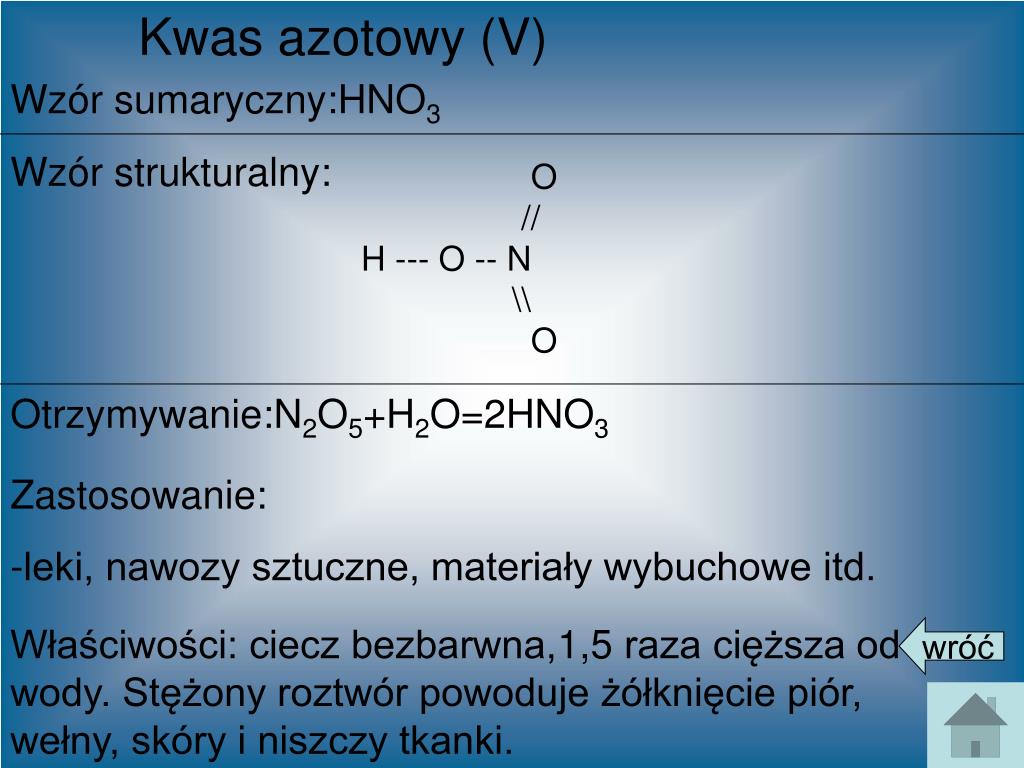
Kwas Fosforowy 5 Wzór Strukturalny
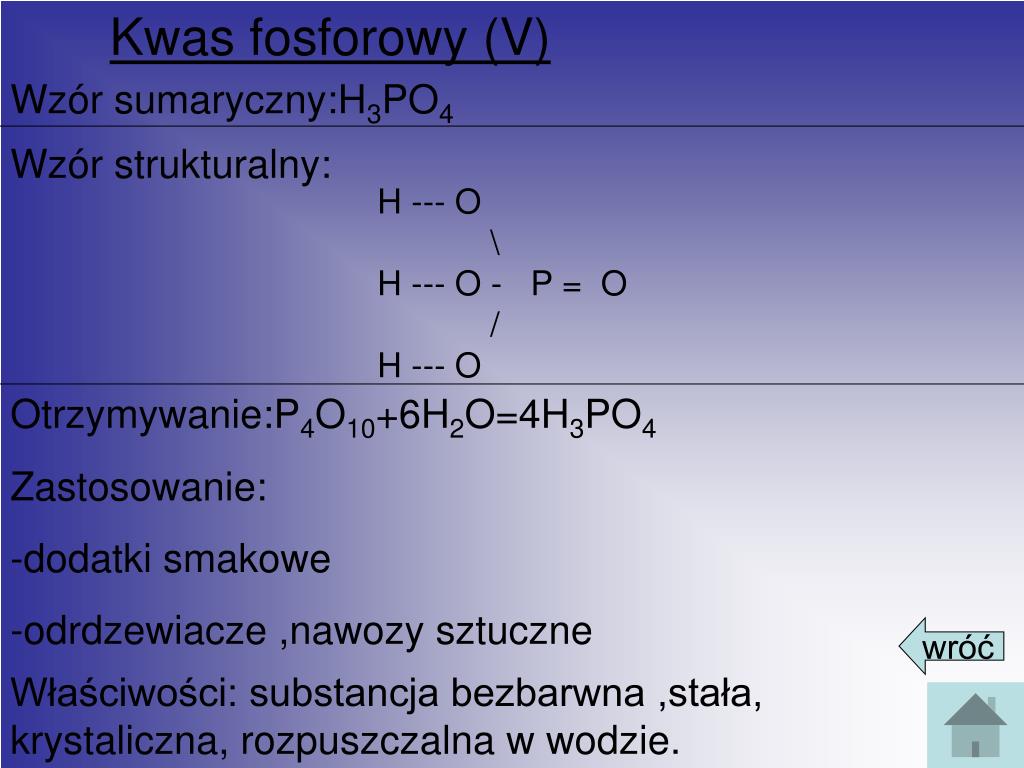
Kwas fosforowy, substancja o szerokim zastosowaniu w przemyśle i laboratoriach, jest kluczowym związkiem chemicznym. W tym artykule przyjrzymy się bliżej kwasowi fosforowemu, ze szczególnym naciskiem na wzór strukturalny H3PO4 oraz jego znaczenie. Naszym celem jest przybliżenie tej wiedzy zarówno studentom chemii, jak i osobom zainteresowanym naukami przyrodniczymi, tak aby zrozumienie struktury kwasu fosforowego stało się proste i intuicyjne.
Czym jest Kwas Fosforowy?
Kwas fosforowy, o wzorze sumarycznym H3PO4, jest nieorganicznym kwasem, będącym pochodną fosforu. W czystej postaci występuje jako ciało stałe, jednak zazwyczaj spotykamy go w formie roztworów wodnych o różnym stężeniu. Jest to kwas trójprotonowy, co oznacza, że może oddawać trzy jony wodorowe (protony) w reakcjach chemicznych. To właśnie ta właściwość determinuje jego zachowanie i różnorodność zastosowań.
Zastosowania Kwasu Fosforowego
Kwas fosforowy znajduje szerokie zastosowanie w różnych dziedzinach:
- Przemysł nawozowy: Jest podstawowym składnikiem nawozów fosforowych, niezbędnych dla wzrostu roślin.
- Przemysł spożywczy: Dodawany do napojów (np. typu cola) jako regulator kwasowości i środek konserwujący. Używany również w produkcji sera i innych produktów spożywczych.
- Przemysł farmaceutyczny: Wykorzystywany w produkcji leków i suplementów diety.
- Przemysł metalurgiczny: Stosowany do trawienia metali i oczyszczania powierzchni.
- Laboratoria: Używany jako odczynnik chemiczny w różnego rodzaju analizach i syntezach.
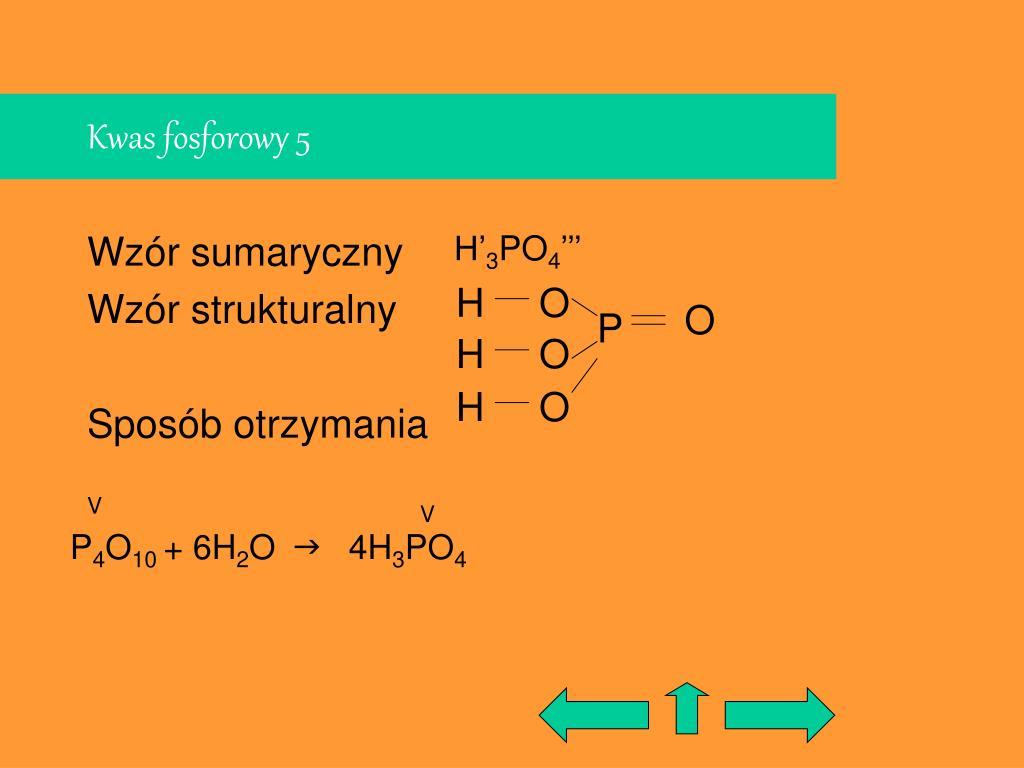
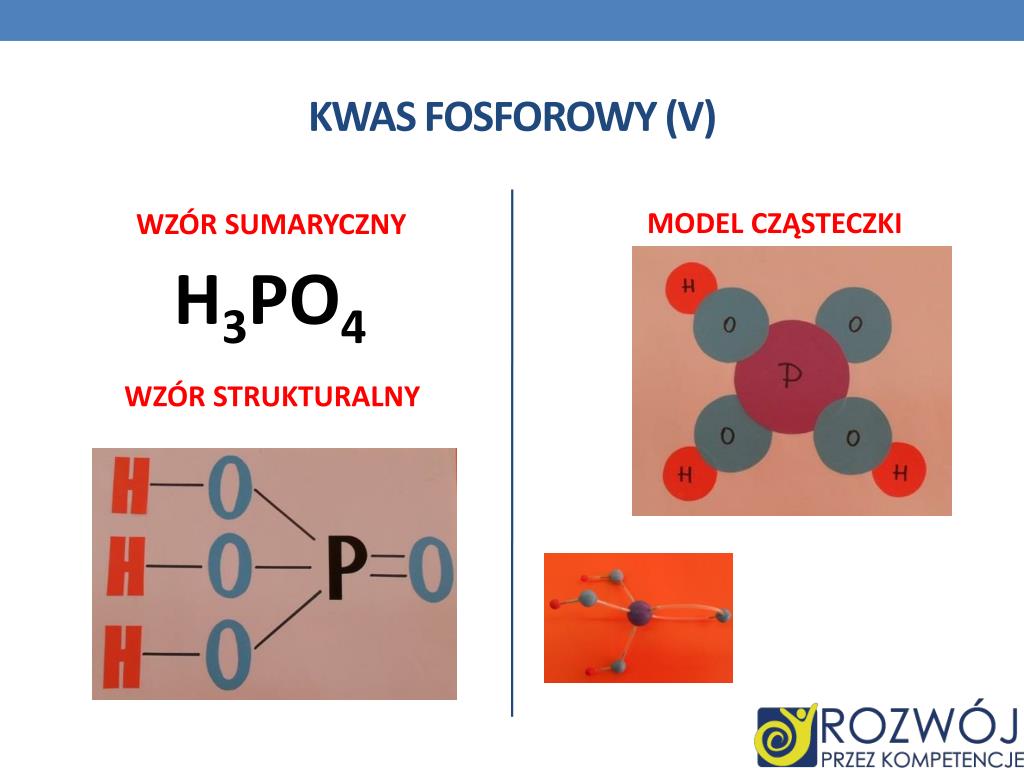
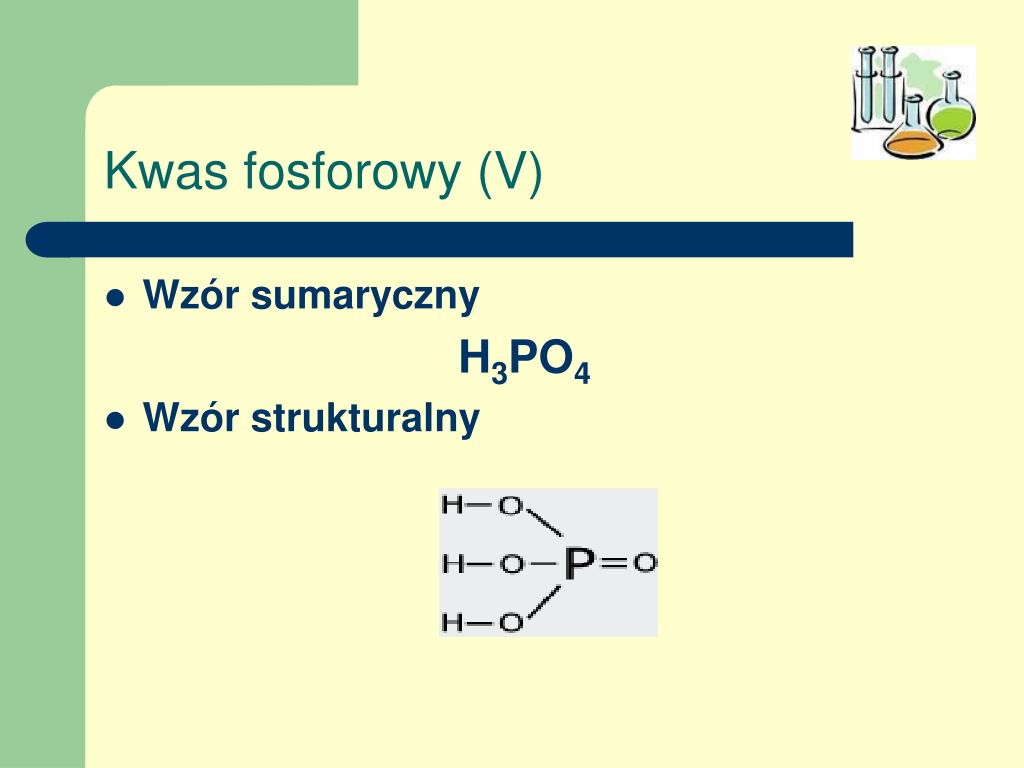
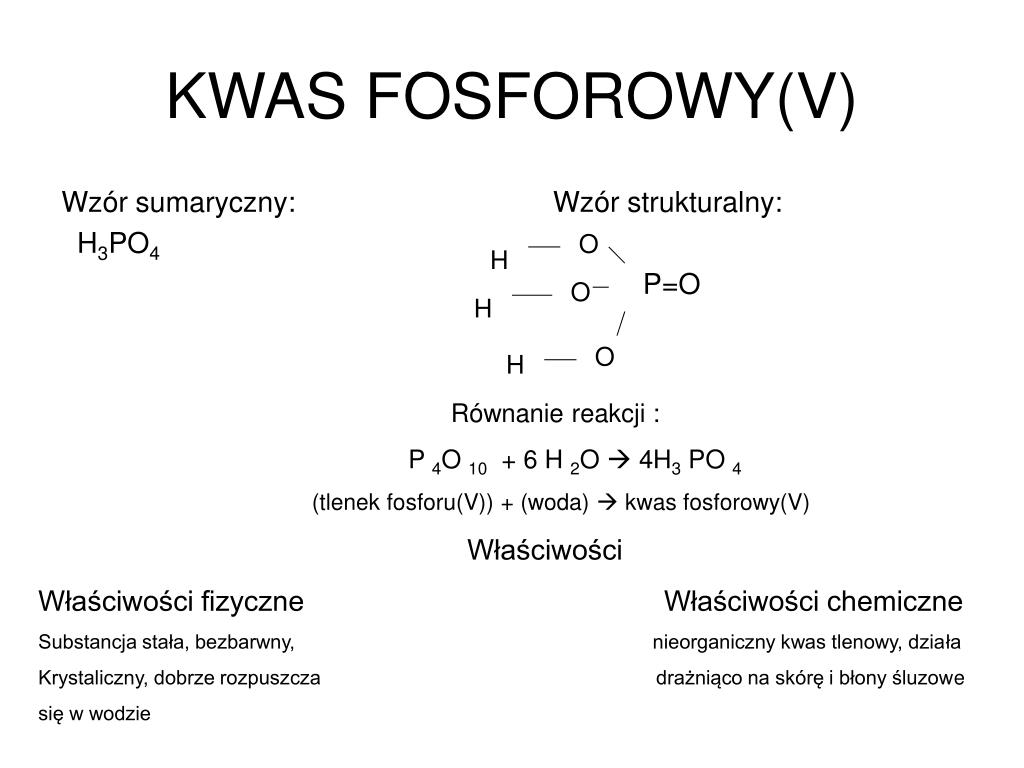
Wzór Strukturalny Kwasu Fosforowego: H3PO4
Zrozumienie wzoru strukturalnego kwasu fosforowego jest kluczowe do poznania jego właściwości i reaktywności. Wzór strukturalny ukazuje, jak atomy są połączone ze sobą w cząsteczce.
Analiza Wzoru Strukturalnego
Wzór strukturalny kwasu fosforowego przedstawia centralny atom fosforu (P), który jest połączony z czterema atomami tlenu (O). Jeden z atomów tlenu jest połączony z atomem fosforu podwójnym wiązaniem (P=O), natomiast pozostałe trzy atomy tlenu są połączone pojedynczym wiązaniem (P-O). Do każdego z tych trzech atomów tlenu dołączony jest atom wodoru (H), tworząc grupy hydroksylowe (-OH). Zatem, pełny wzór strukturalny można przedstawić następująco:

Kluczowe elementy wzoru strukturalnego:
- Atom fosforu (P): Centralny atom, posiadający pięć elektronów walencyjnych, co pozwala na tworzenie pięciu wiązań.
- Atom tlenu (O): Cztery atomy tlenu otaczające atom fosforu.
- Wiązanie podwójne (P=O): Bardzo silne wiązanie, które stabilizuje cząsteczkę.
- Grupy hydroksylowe (-OH): Trzy grupy hydroksylowe, które nadają kwasowy charakter cząsteczce. Atomy wodoru w tych grupach mogą być oddawane jako protony.
Znaczenie Wzoru Strukturalnego
Wzór strukturalny kwasu fosforowego wyjaśnia jego właściwości kwasowe. Obecność trzech grup hydroksylowych (-OH) umożliwia oddawanie trzech protonów (H+) w roztworze wodnym, co czyni go kwasem trójprotonowym. Proces dysocjacji kwasu fosforowego przebiega stopniowo, co oznacza, że każdy proton jest oddawany z inną łatwością. Powoduje to powstawanie jonów takich jak H2PO4- (jon diwodorofosforanowy), HPO42- (jon wodorofosforanowy) i PO43- (jon fosforanowy).
Zrozumienie kolejności dysocjacji i powstawania tych jonów jest bardzo ważne w wielu zastosowaniach, np. w buforach fosforanowych, które utrzymują stałe pH w roztworach.
Właściwości Kwasu Fosforowego
Kwas fosforowy wykazuje szereg charakterystycznych właściwości, które wynikają z jego struktury i zdolności do dysocjacji:
- Kwasowość: Jak wspomniano, jest to kwas trójprotonowy, co oznacza, że może oddawać trzy protony.
- Higroskopijność: Kwas fosforowy jest higroskopijny, czyli pochłania wilgoć z otoczenia.
- Reaktywność: Reaguje z zasadami, tworząc sole – fosforany.
- Stabilność: W normalnych warunkach jest stosunkowo stabilny, jednak pod wpływem wysokiej temperatury może ulegać kondensacji, tworząc kwasy polifosforowe.
Wpływ Struktury na Właściwości
Wiązanie podwójne P=O wpływa na stabilność cząsteczki, a obecność grup hydroksylowych determinuje jej kwasowość. Zdolność do tworzenia wiązań wodorowych przez grupy hydroksylowe sprawia, że kwas fosforowy dobrze rozpuszcza się w wodzie i jest higroskopijny.
Kwas Fosforowy a Kwasy Polifosforowe
Warto wspomnieć o kwasach polifosforowych, które powstają w wyniku kondensacji kilku cząsteczek kwasu fosforowego z odszczepieniem cząsteczek wody. Przykładowo, kwas pirofosforowy (H4P2O7) powstaje przez połączenie dwóch cząsteczek kwasu fosforowego.
H3PO4 + H3PO4 → H4P2O7 + H2O
Kwasy polifosforowe mają również szerokie zastosowanie, np. w przemyśle detergentów i w chemii analitycznej.
Podsumowanie
Kwas fosforowy (H3PO4) jest wszechstronnym związkiem chemicznym o fundamentalnym znaczeniu w wielu dziedzinach. Jego wzór strukturalny wyjaśnia jego właściwości kwasowe, higroskopijność i reaktywność. Zrozumienie struktury kwasu fosforowego i jego pochodnych jest kluczowe dla dalszego zgłębiania wiedzy z zakresu chemii i nauk pokrewnych. Mamy nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć ten istotny związek. Pamiętaj, chemia to fascynująca dziedzina, pełna ciekawych połączeń i zależności! Zachęcamy do dalszego poszerzania wiedzy i eksperymentowania.
Znajomość wzoru strukturalnego i właściwości kwasu fosforowego może być bardzo pomocna w wielu dziedzinach życia, od rolnictwa po medycynę. Zatem, kontynuuj swoją edukację chemiczną i odkrywaj tajemnice otaczającego nas świata!