Kowalencyjne Niespolaryzowane

Wyobraź sobie idealnie równą huśtawkę. Po obu jej stronach siedzą dwie identyczne osoby. Nikt nie jest cięższy, nikt nie próbuje dominować. Siła przyciągania jest rozłożona idealnie po równo. Tak właśnie działa wiązanie kowalencyjne niespolaryzowane. Ale czym ono dokładnie jest i dlaczego jest tak ważne? Ten artykuł jest skierowany do studentów chemii, uczniów szkół średnich, oraz każdego, kto chce poszerzyć swoją wiedzę na temat świata molekularnego. Postaramy się przybliżyć to zagadnienie w sposób zrozumiały i przystępny, bez zbędnego żargonu.
Czym jest wiązanie kowalencyjne?
Zanim zagłębimy się w specyfikę wiązań kowalencyjnych niespolaryzowanych, przypomnijmy sobie, czym w ogóle jest wiązanie kowalencyjne. Mówiąc najprościej, jest to rodzaj wiązania chemicznego, w którym atomy współdzielą elektrony, aby osiągnąć bardziej stabilną konfigurację elektronową (zwykle oktet elektronowy, czyli osiem elektronów na powłoce walencyjnej, z wyjątkiem wodoru, który dąży do duetu). Dzieje się tak, ponieważ atomy, zwłaszcza niemetale, "chcą" mieć pełną powłokę walencyjną, co czyni je bardziej stabilnymi energetycznie.
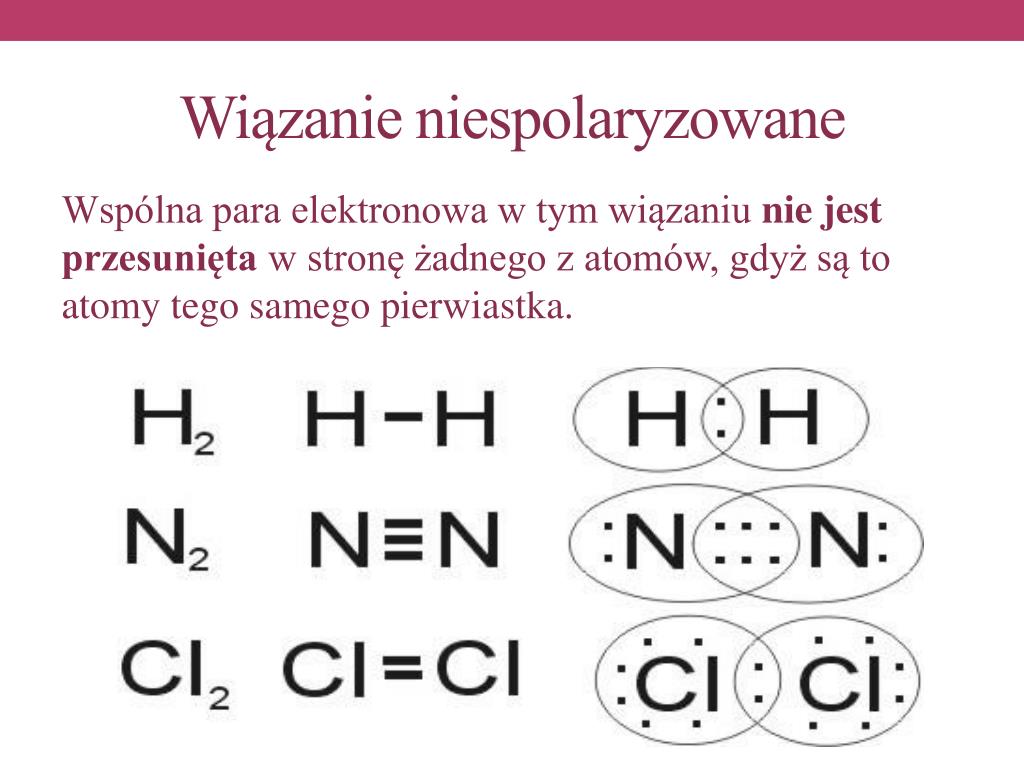
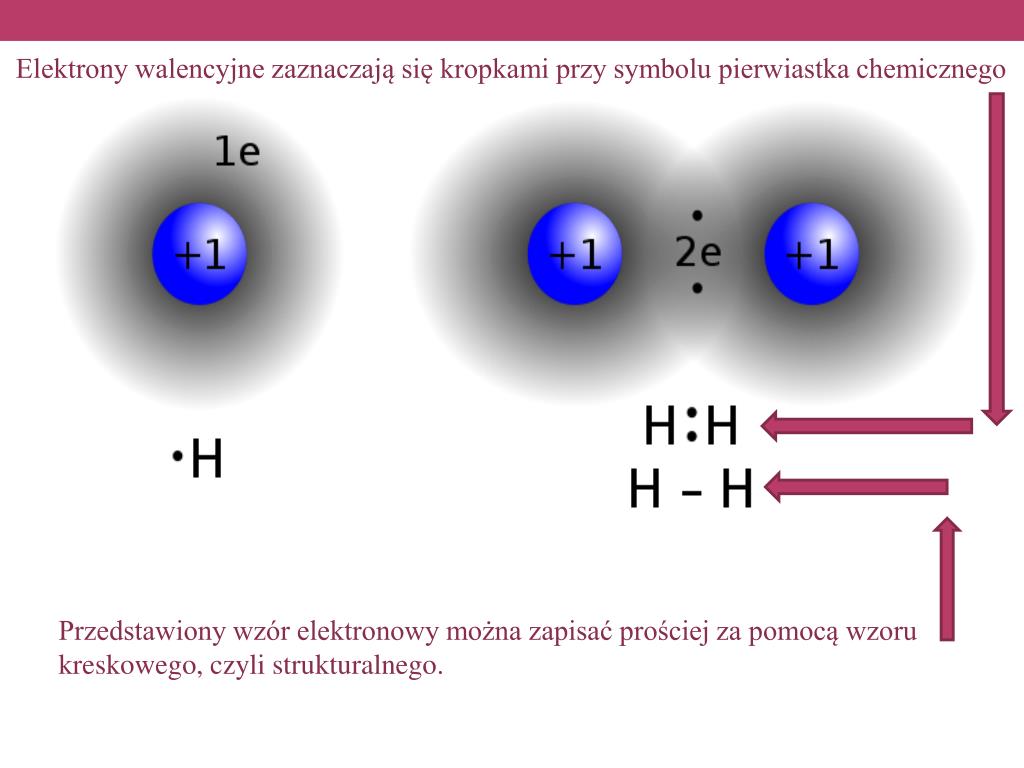
Rozważmy atom wodoru (H). Posiada on tylko jeden elektron. Aby osiągnąć stabilną konfigurację duetu (dwa elektrony, tak jak hel), potrzebuje jeszcze jednego elektronu. Dwa atomy wodoru mogą podzielić się swoimi elektronami, tworząc wiązanie kowalencyjne i cząsteczkę wodoru (H2). Każdy atom wodoru "czuje się", jakby miał dwa elektrony, co czyni go bardziej stabilnym.
Wiązanie Kowalencyjne Niespolaryzowane: Równy Podział Elektroniczny
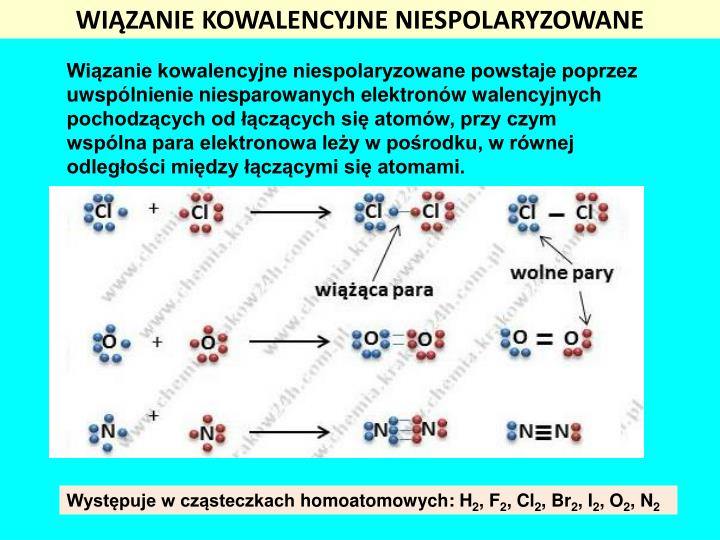
Teraz przejdźmy do sedna sprawy: wiązanie kowalencyjne niespolaryzowane. Kluczowe słowo to "niespolaryzowane". Oznacza to, że elektrony są równo współdzielone między atomami tworzącymi wiązanie. Ale kiedy to się dzieje?
Dzieje się tak, gdy wiązanie tworzą:
- Dwa identyczne atomy: Na przykład, wiązanie w cząsteczce wodoru (H2), tlenu (O2), azotu (N2), chloru (Cl2) i innych pierwiastków występujących w postaci cząsteczek dwuatomowych.
- Atomy o bardzo zbliżonej elektroujemności: Elektroujemność to zdolność atomu do przyciągania elektronów w wiązaniu chemicznym. Jeżeli różnica elektroujemności między dwoma atomami jest bardzo mała (zazwyczaj poniżej 0.4 w skali Paulinga), uznajemy wiązanie za niespolaryzowane.
W przypadku identycznych atomów sytuacja jest prosta: oba atomy mają identyczną siłę przyciągania elektronów, więc żaden z nich nie "dominuje" w wiązaniu. Elektrony są rozłożone równomiernie pomiędzy jądrami atomowymi.
Gdy mamy atomy o bardzo zbliżonej elektroujemności, różnica w sile przyciągania elektronów jest na tyle mała, że elektrony wciąż są uważane za równo współdzielone. Przykładowo, wiązanie w cząsteczce metanu (CH4) pomiędzy węglem i wodorem można w przybliżeniu traktować jako wiązanie niespolaryzowane, choć istnieje niewielka różnica elektroujemności.
Elektroujemność: Klucz do Zrozumienia Polarności Wiązań
Zrozumienie koncepcji elektroujemności jest kluczowe do rozróżnienia wiązań spolaryzowanych i niespolaryzowanych. Elektroujemność, jak wspomniano wcześniej, to miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym. Została ona usystematyzowana w skali Paulinga, gdzie fluor (F) ma najwyższą elektroujemność (3.98), a cez (Cs) najniższą (0.79).
Im większa różnica elektroujemności między dwoma atomami tworzącymi wiązanie, tym bardziej spolaryzowane jest wiązanie. Wiązanie staje się spolaryzowane, gdy jeden atom przyciąga elektrony mocniej niż drugi. Powoduje to powstanie częściowego ładunku ujemnego (δ-) na atomie o wyższej elektroujemności i częściowego ładunku dodatniego (δ+) na atomie o niższej elektroujemności. Mówimy wtedy o dipolu elektrycznym.
Dla wiązania kowalencyjnego niespolaryzowanego, różnica elektroujemności jest bardzo mała lub zerowa, dlatego nie obserwujemy powstawania ładunków częściowych.
Właściwości Związków z Wiązaniami Kowalencyjnymi Niespolaryzowanymi
Obecność wiązań kowalencyjnych niespolaryzowanych w cząsteczce ma istotny wpływ na jej właściwości fizyczne i chemiczne. Związki z dominującymi wiązaniami niespolaryzowanymi zazwyczaj charakteryzują się:
- Niską temperaturą wrzenia i topnienia: Siły międzycząsteczkowe (np. siły van der Waalsa) są słabe, ponieważ brak jest wyraźnych biegunów.
- Słabą rozpuszczalnością w wodzie (rozpuszczalnikach polarnych): "Podobne rozpuszcza się w podobnym". Woda jest rozpuszczalnikiem polarnym, a związki niespolaryzowane nie oddziałują z nią wystarczająco silnie, aby się rozpuścić.
- Dobrą rozpuszczalnością w rozpuszczalnikach organicznych (rozpuszczalnikach niepolarnych): Związki niespolaryzowane dobrze rozpuszczają się w rozpuszczalnikach, które same są niespolaryzowane, takich jak heksan, benzen czy toluen.
- Brakiem przewodnictwa elektrycznego: Elektrony są silnie związane w wiązaniach kowalencyjnych i nie są swobodne do poruszania się, co uniemożliwia przewodzenie prądu.
Przykłady takich związków to: metan (CH4), etan (C2H6), heksan (C6H14), benzen (C6H6), oraz większość węglowodorów. Są to często substancje oleiste, tłuste i łatwopalne.
Przykłady Wiązań Kowalencyjnych Niespolaryzowanych w Praktyce
Spójrzmy na kilka konkretnych przykładów, aby lepiej zrozumieć, gdzie spotykamy wiązania kowalencyjne niespolaryzowane:
- Cząsteczka wodoru (H2): Jak już wspomniano, jest to klasyczny przykład. Dwa identyczne atomy wodoru dzielą się elektronami równo.
- Cząsteczka tlenu (O2): Podobnie, dwa atomy tlenu tworzą wiązanie kowalencyjne niespolaryzowane. Tlen jest niezbędny do życia, a jego właściwości wynikają między innymi z natury jego wiązań.
- Węglowodory: Większość węglowodorów, takich jak metan, etan, propan i butan, zawiera głównie wiązania C-H i C-C. Wiązania C-H są, jak wspomniano, w przybliżeniu traktowane jako niespolaryzowane, a wiązania C-C są idealnie niespolaryzowane. Węglowodory stanowią podstawę paliw kopalnych i są szeroko wykorzystywane w przemyśle chemicznym.
- Oleje i tłuszcze: Są to estry glicerolu i kwasów tłuszczowych. Kwasy tłuszczowe zawierają długie łańcuchy węglowodorowe, co czyni je związkami o charakterze niespolaryzowanym. To dlatego oleje i tłuszcze nie mieszają się z wodą.
Znaczenie Wiązań Kowalencyjnych Niespolaryzowanych w Biologii
Choć wiązania polaryzowane często odgrywają kluczową rolę w reakcjach biologicznych ze względu na swoją interakcję z wodą, wiązania niespolaryzowane są równie ważne. Błony komórkowe są doskonałym przykładem. Błony komórkowe są zbudowane z fosfolipidów, które posiadają "główkę" polarną i dwa "ogony" niepolarne (łańcuchy węglowodorowe). Te niepolarne ogony skupiają się wewnątrz błony, tworząc barierę, która zapobiega swobodnemu przepływowi polarnych cząsteczek (takich jak jony i woda) przez błonę. To selektywne przepuszczanie jest kluczowe dla prawidłowego funkcjonowania komórki.
Dodatkowo, interakcje hydrofobowe (interakcje między cząsteczkami niespolaryzowanymi w środowisku wodnym) odgrywają istotną rolę w strukturze białek. Niepolarne aminokwasy dążą do skupiania się wewnątrz białka, z dala od wody, co przyczynia się do jego fałdowania i stabilności. Te interakcje są niezbędne dla prawidłowego działania enzymów i innych białek.
Podsumowanie: Dlaczego Warto Znać Wiązania Kowalencyjne Niespolaryzowane?
Wiązania kowalencyjne niespolaryzowane, choć na pierwszy rzut oka mogą wydawać się prostym pojęciem, mają ogromne znaczenie dla zrozumienia właściwości materii. Znajomość tego zagadnienia pozwala nam:
- Przewidywać właściwości fizyczne i chemiczne związków: Rozpuszczalność, temperatura wrzenia, reaktywność – to wszystko zależy od rodzaju wiązań w cząsteczce.
- Rozumieć procesy zachodzące w biologii: Od struktury błon komórkowych po fałdowanie białek – wiązania niespolaryzowane są obecne wszędzie.
- Projektować nowe materiały: Znając zależności między strukturą a właściwościami, możemy tworzyć materiały o pożądanych cechach.
Mamy nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć świat wiązań kowalencyjnych niespolaryzowanych. Pamiętaj, że chemia to nauka, która pozwala nam zrozumieć, jak działa świat na poziomie molekularnym. Zatem, eksploruj, pytaj i ucz się dalej!


.jpg)