Jak Odróżnić Alkohol Monohydroksylowy Od Polihydroksylowego

Alkohol to grupa związków organicznych charakteryzująca się obecnością grupy hydroksylowej (-OH) przyłączonej do atomu węgla. W zależności od liczby grup hydroksylowych w cząsteczce, alkohole dzielimy na monohydroksylowe (posiadające jedną grupę -OH) oraz polihydroksylowe (posiadające więcej niż jedną grupę -OH). Rozróżnienie tych dwóch typów alkoholi jest kluczowe w chemii organicznej, biochemii i wielu zastosowaniach przemysłowych. Chociaż często wymagają one skomplikowanych analiz laboratoryjnych, istnieją pewne charakterystyczne różnice w ich właściwościach fizycznych i chemicznych, które można wykorzystać do ich wstępnego rozróżnienia.
Właściwości Fizyczne i Chemiczne
Podstawowym kryterium różnicującym alkohole monohydroksylowe i polihydroksylowe jest liczba grup hydroksylowych. Ma to bezpośredni wpływ na właściwości, takie jak temperatura wrzenia, rozpuszczalność w wodzie i reaktywność chemiczna.
Alkohole monohydroksylowe, takie jak etanol (alkohol etylowy) czy metanol (alkohol metylowy), charakteryzują się tym, że w ich cząsteczce znajduje się tylko jedna grupa -OH. Im krótszy łańcuch węglowy, tym alkohol jest bardziej rozpuszczalny w wodzie. Metanol i etanol mieszają się z wodą w dowolnych proporcjach. Wraz ze wzrostem długości łańcucha węglowego rozpuszczalność alkoholu w wodzie maleje, ponieważ dominuje hydrofobowy charakter łańcucha węglowego. Temperatury wrzenia alkoholi monohydroksylowych rosną wraz z wydłużaniem się łańcucha węglowego, ze względu na zwiększające się siły van der Waalsa pomiędzy cząsteczkami.
Alkohole polihydroksylowe, znane również jako poliole, posiadają więcej niż jedną grupę hydroksylową w swojej strukturze. Typowymi przykładami są glikol etylenowy (etan-1,2-diol) i glicerol (propan-1,2,3-triol). Obecność wielu grup -OH powoduje, że alkohole te są znacznie bardziej polarne niż alkohole monohydroksylowe. To z kolei przekłada się na ich lepszą rozpuszczalność w wodzie i wyższe temperatury wrzenia. Glicerol, na przykład, jest lepki i bardzo dobrze miesza się z wodą. Silne wiązania wodorowe tworzone pomiędzy cząsteczkami poliolów przyczyniają się do ich wysokich temperatur wrzenia.
Rozpuszczalność w Wodzie
Jak wspomniano wcześniej, rozpuszczalność w wodzie jest istotną cechą różnicującą alkohole monohydroksylowe i polihydroksylowe. Alkohole monohydroksylowe o krótkich łańcuchach węglowych (np. metanol, etanol, propanol) są dobrze rozpuszczalne w wodzie ze względu na dominujący wpływ polarności grupy -OH. Jednak wraz ze wzrostem długości łańcucha węglowego, hydrofobowy charakter węglowodorowego łańcucha staje się bardziej znaczący, zmniejszając rozpuszczalność alkoholu w wodzie. Przykładowo, butanol jest już mniej rozpuszczalny, a alkohole o jeszcze dłuższych łańcuchach stają się praktycznie nierozpuszczalne w wodzie.
Alkohole polihydroksylowe natomiast charakteryzują się bardzo dobrą rozpuszczalnością w wodzie, niezależnie od długości łańcucha węglowego. Obecność wielu grup -OH umożliwia tworzenie licznych wiązań wodorowych z cząsteczkami wody, co znacząco zwiększa rozpuszczalność. Glikol etylenowy i glicerol są przykładami alkoholi polihydroksylowych, które mieszają się z wodą w dowolnych proporcjach. Ich wysoka higroskopijność (zdolność do pochłaniania wilgoci z otoczenia) również jest związana z obecnością wielu grup hydroksylowych.
Reakcje Chemiczne
Reaktywność chemiczna alkoholi, zarówno monohydroksylowych, jak i polihydroksylowych, jest w dużej mierze determinowana obecnością grupy -OH. Jednak liczba grup -OH w cząsteczce wpływa na charakter i szybkość reakcji.
Alkohole monohydroksylowe podlegają szeregowi reakcji, takich jak utlenianie, estryfikacja, dehydratacja i reakcje z metalami aktywnymi. Utlenianie alkoholi monohydroksylowych prowadzi do powstania aldehydów (w przypadku alkoholi pierwszorzędowych) lub ketonów (w przypadku alkoholi drugorzędowych). Alkohole trzeciorzędowe są trudne do utlenienia. Estryfikacja polega na reakcji alkoholu z kwasem karboksylowym, w wyniku której powstaje ester i woda. Dehydratacja to proces eliminacji wody z cząsteczki alkoholu, prowadzący do powstania alkenu.
Alkohole polihydroksylowe wykazują podobne reakcje jak alkohole monohydroksylowe, ale z pewnymi różnicami wynikającymi z obecności wielu grup -OH. Mogą one ulegać reakcjom estryfikacji z wieloma grupami kwasów karboksylowych, tworząc poliestry. Utlenianie alkoholi polihydroksylowych może prowadzić do powstania związków zawierających wiele grup karbonylowych (aldehydowych lub ketonowych). Dodatkowo, alkohole polihydroksylowe mogą uczestniczyć w reakcjach cyklizacji, w których grupy -OH reagują ze sobą, tworząc pierścienie.
Testy Laboratoryjne
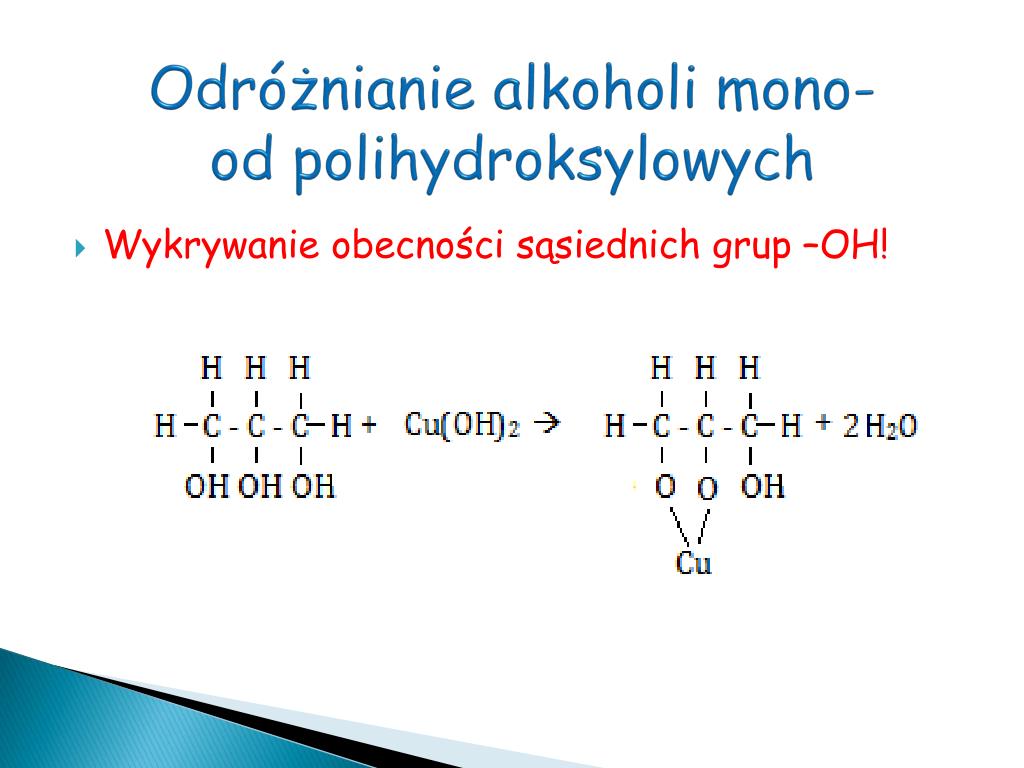
W praktyce laboratoryjnej, rozróżnienie alkoholi monohydroksylowych i polihydroksylowych często wymaga zastosowania bardziej zaawansowanych metod analitycznych, takich jak spektroskopia (np. NMR, IR) i chromatografia (np. GC-MS). Jednak niektóre proste testy chemiczne mogą dać wstępne informacje o rodzaju badanego alkoholu.
Test Lucasa jest używany do rozróżniania alkoholi pierwszorzędowych, drugorzędowych i trzeciorzędowych. Polega on na reakcji alkoholu z odczynnikiem Lucasa (roztwór chlorku cynku w stężonym kwasie solnym). Obserwuje się zmętnienie roztworu w wyniku tworzenia się nierozpuszczalnego chlorku alkilu. Alkohole trzeciorzędowe reagują natychmiast, drugorzędowe reagują po kilku minutach, a alkohole pierwszorzędowe reagują bardzo wolno lub wcale. Chociaż test ten nie rozróżnia bezpośrednio alkoholi monohydroksylowych od polihydroksylowych, może pomóc w identyfikacji rodzaju alkoholu.
Reakcja z odczynnikiem Fehlinga lub Tollensa może być wykorzystana do wykrywania obecności grup aldehydowych, które mogą powstać w wyniku utleniania alkoholi. Jednak test ten nie jest specyficzny dla alkoholi polihydroksylowych i może dać pozytywny wynik również w przypadku alkoholi monohydroksylowych, które uległy utlenieniu do aldehydów.
Podsumowanie Różnic
-
Liczba Grup Hydroksylowych: Najbardziej fundamentalna różnica, alkohole monohydroksylowe mają jedną grupę -OH, a polihydroksylowe mają więcej niż jedną.
-
Rozpuszczalność w Wodzie: Polihydroksylowe alkohole są zazwyczaj znacznie bardziej rozpuszczalne w wodzie niż alkohole monohydroksylowe o podobnej masie cząsteczkowej.
-
Temperatura Wrzenia: Polihydroksylowe alkohole mają wyższe temperatury wrzenia niż alkohole monohydroksylowe o porównywalnej masie cząsteczkowej, ze względu na silniejsze wiązania wodorowe.
-
Reaktywność Chemiczna: Chociaż oba typy alkoholi podlegają podobnym reakcjom, obecność wielu grup -OH w alkoholach polihydroksylowych wpływa na charakter i szybkość tych reakcji.
-
Lepkość: Alkohole polihydroksylowe, ze względu na liczne wiązania wodorowe są często bardziej lepkie niż ich monohydroksylowe odpowiedniki.
Zastosowania
Alkohole monohydroksylowe i polihydroksylowe znajdują szerokie zastosowanie w różnych dziedzinach. Alkohole monohydroksylowe, takie jak etanol, są używane jako rozpuszczalniki, środki dezynfekujące, paliwa i składniki napojów alkoholowych. Metanol jest stosowany w przemyśle chemicznym jako surowiec do produkcji formaldehydu i innych związków.
Zastosowanie Alkoholi Polihydroksylowych
Alkohole polihydroksylowe, takie jak glikol etylenowy i glicerol, mają również liczne zastosowania. Glikol etylenowy jest używany jako płyn chłodniczy w samochodach, a także jako surowiec do produkcji włókien poliestrowych. Glicerol jest stosowany w kosmetykach, farmacji i przemyśle spożywczym jako środek nawilżający, zmiękczający i rozpuszczalnik. Dodatkowo, glicerol jest substratem do produkcji nitrogliceryny, która jest składnikiem materiałów wybuchowych i leków rozszerzających naczynia krwionośne. Inne poliole, takie jak ksylitol i sorbitol, są stosowane jako substancje słodzące w produktach dla diabetyków.
Zrozumienie różnic między alkoholami monohydroksylowymi i polihydroksylowymi jest kluczowe dla właściwego wykorzystania ich w różnych zastosowaniach. Poznanie ich właściwości fizycznych i chemicznych pozwala na optymalny dobór alkoholu do konkretnego zadania i przewidywanie jego zachowania w różnych warunkach. Od prostych testów laboratoryjnych po zaawansowane metody analityczne, istnieje wiele sposobów na rozróżnienie tych dwóch ważnych grup związków organicznych.