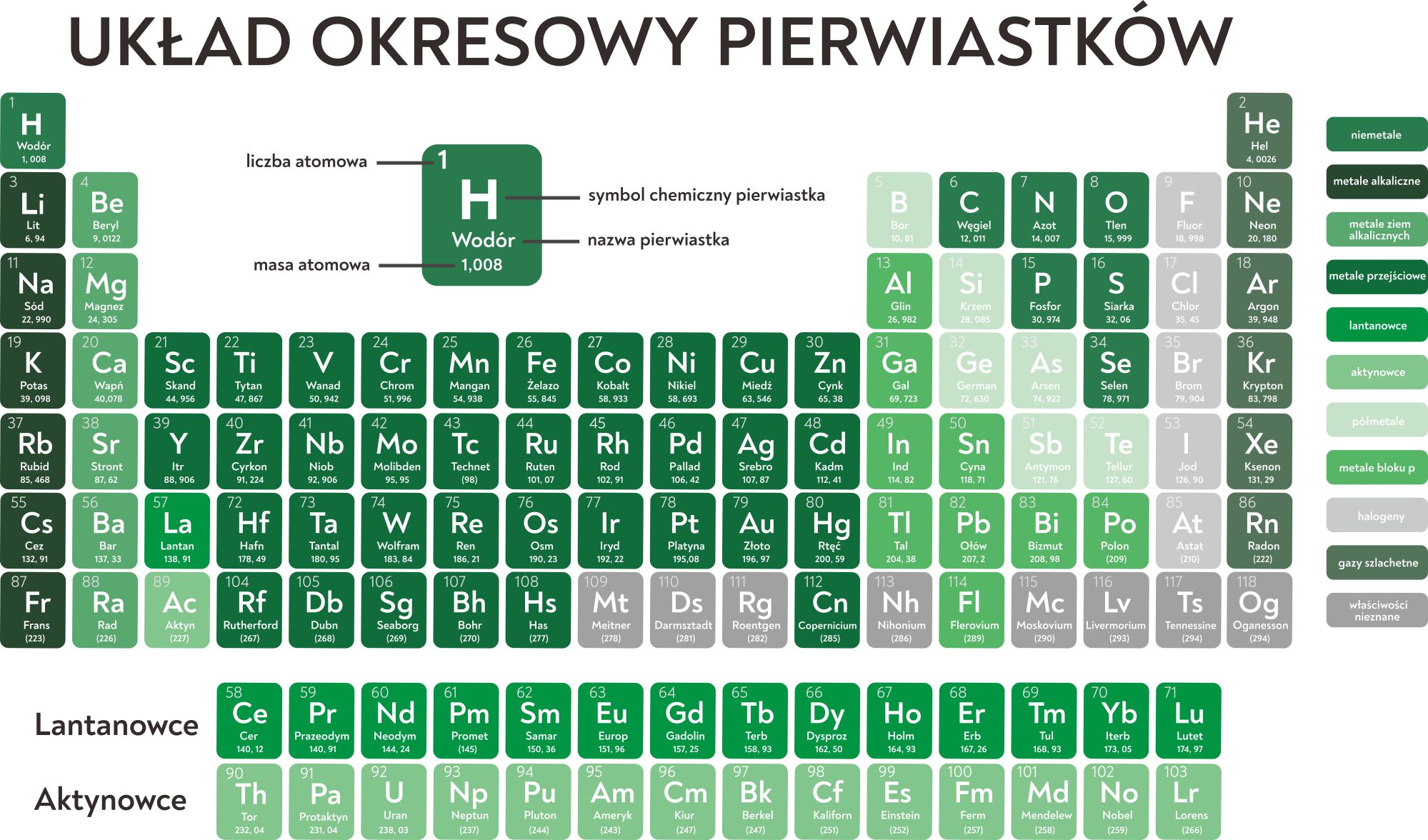
Jak Odczytywać Wartościowość Pierwiastków Z Układu Okresowego

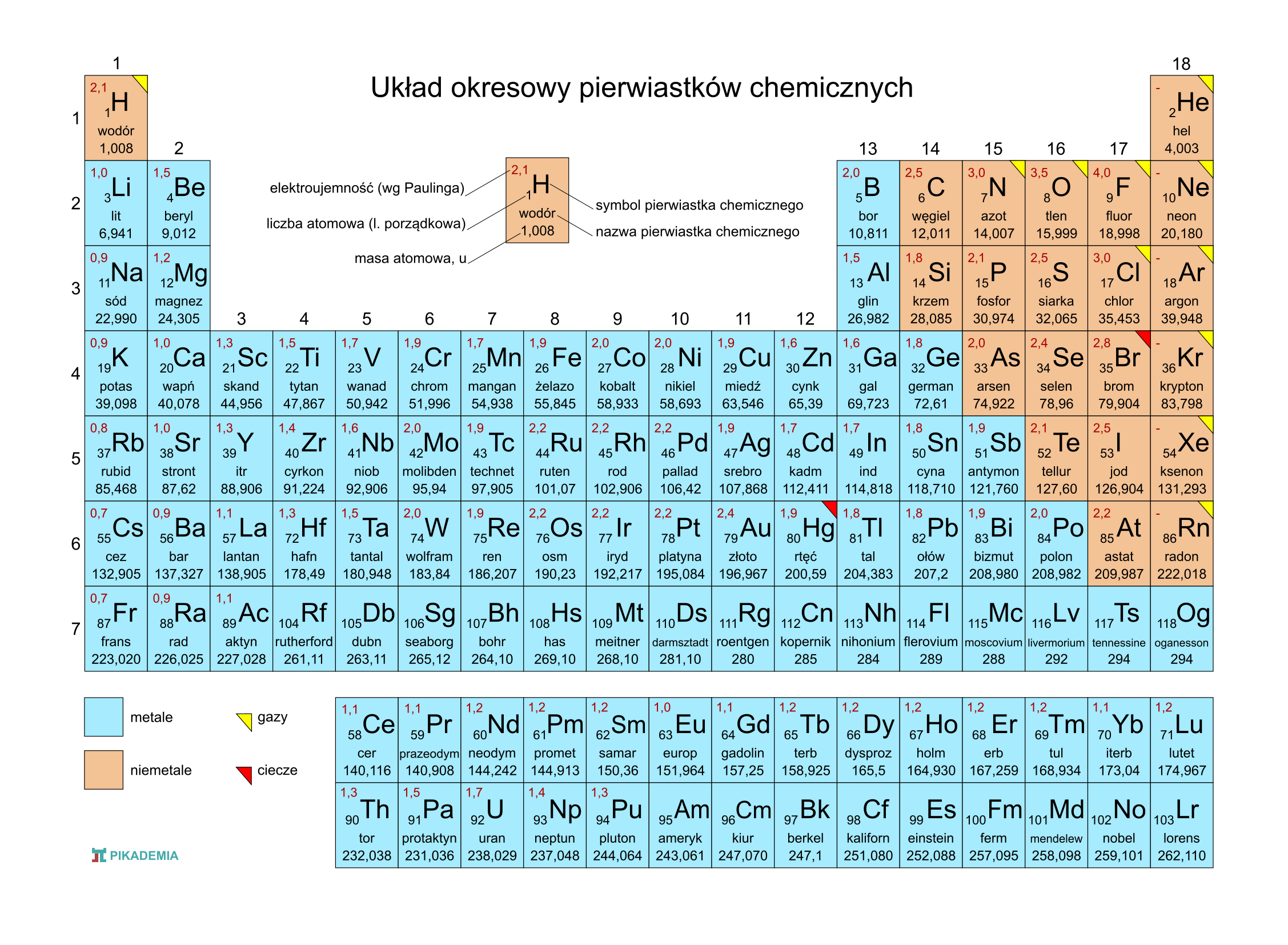
Odczytywanie wartościowości pierwiastków z układu okresowego może wydawać się skomplikowane na pierwszy rzut oka, ale po zrozumieniu kilku podstawowych zasad, proces ten staje się prosty i intuicyjny. Układ okresowy jest cennym narzędziem, które dostarcza nam informacji o właściwościach chemicznych pierwiastków, w tym o ich wartościowości. Wartościowość określa, ile wiązań dany atom jest w stanie utworzyć z innymi atomami.
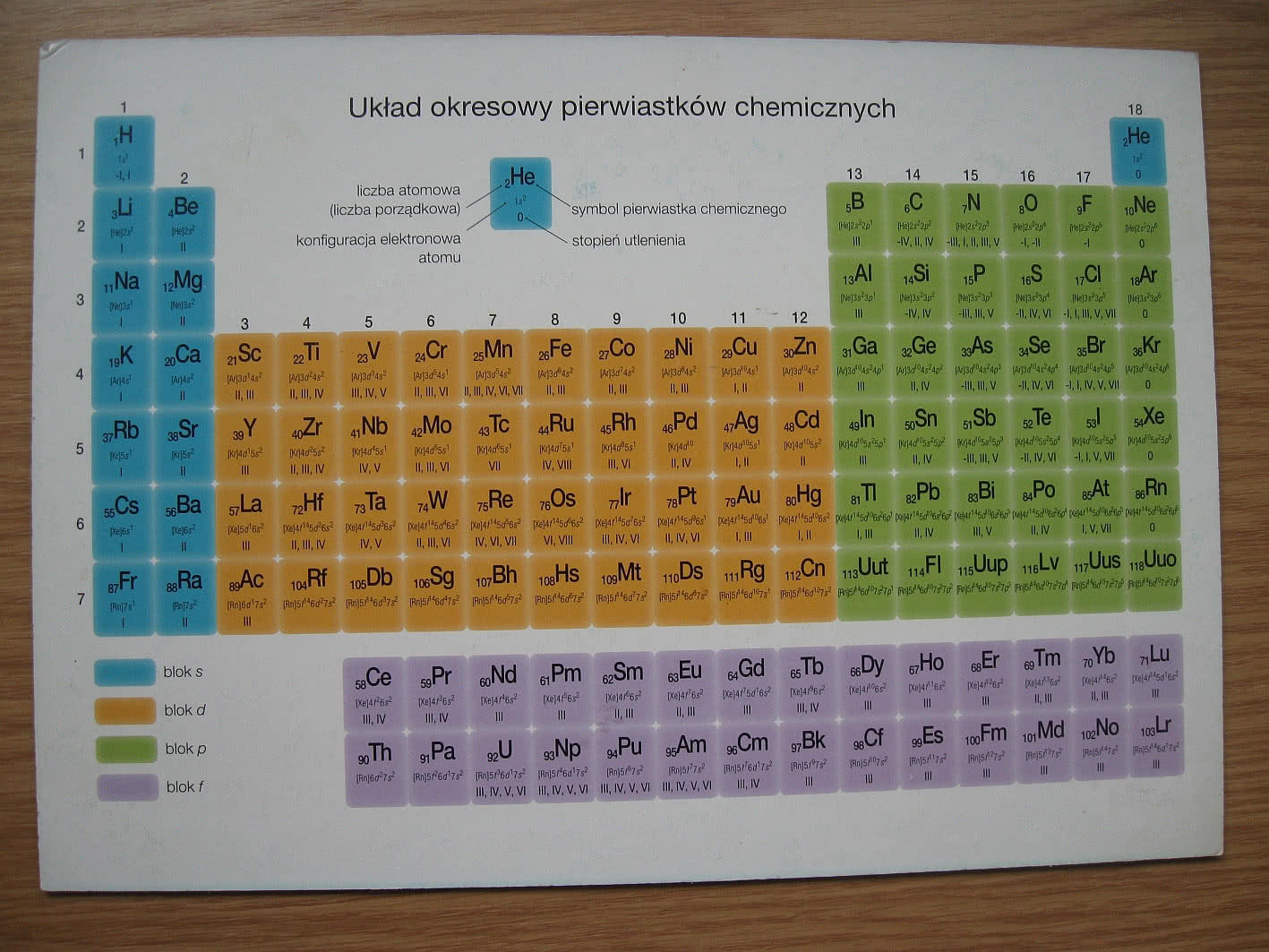
Wartościowość zazwyczaj wiąże się z liczbą elektronów walencyjnych, czyli tych znajdujących się na najbardziej zewnętrznej powłoce elektronowej atomu. Elektrony walencyjne decydują o tym, jak pierwiastek będzie reagował z innymi pierwiastkami i jakie związki chemiczne będzie tworzył. Układ okresowy jest skonstruowany w taki sposób, że pierwiastki w tej samej grupie (kolumnie) mają podobną konfigurację elektronów walencyjnych, a co za tym idzie – podobną wartościowość.
Zacznijmy od grup głównych, czyli grup 1, 2 oraz od 13 do 17.
-
Grupa 1 (litowce): Pierwiastki tej grupy (lit, sód, potas, rubid, cez, frans) mają jeden elektron walencyjny. Zazwyczaj oddają ten elektron, tworząc jony o ładunku +1. Dlatego też, ich wartościowość wynosi zazwyczaj I.
-
Grupa 2 (berylowce): Pierwiastki tej grupy (beryl, magnez, wapń, stront, bar, rad) mają dwa elektrony walencyjne. Zazwyczaj oddają te dwa elektrony, tworząc jony o ładunku +2. Ich wartościowość wynosi zazwyczaj II.
-
Grupa 13 (borowce): Pierwiastki tej grupy (bor, glin, gal, ind, tal) mają trzy elektrony walencyjne. Bor jest wyjątkiem, a glin, gal, ind i tal zazwyczaj oddają te trzy elektrony, tworząc jony o ładunku +3. Wartościowość wynosi zazwyczaj III.
-
Grupa 14 (węglowce): Pierwiastki tej grupy (węgiel, krzem, german, cyna, ołów) mają cztery elektrony walencyjne. Węgiel tworzy różnorodne związki, w których jego wartościowość wynosi zazwyczaj IV, ale może również przyjmować inne wartości, np. II w tlenku węgla (CO). Krzem, german, cyna i ołów również mogą wykazywać wartościowość IV, ale także II.
-
Grupa 15 (azotowce): Pierwiastki tej grupy (azot, fosfor, arsen, antymon, bizmut) mają pięć elektronów walencyjnych. Azot i fosfor często przyjmują trzy elektrony, tworząc jony o ładunku -3. Ich wartościowość wynosi zazwyczaj III, ale mogą również wykazywać wartościowość V (np. w kwasie azotowym HNO3). Arsen, antymon i bizmut również mogą przyjmować wartościowość III i V.
-
Grupa 16 (tlenowce): Pierwiastki tej grupy (tlen, siarka, selen, tellur, polon) mają sześć elektronów walencyjnych. Tlen zazwyczaj przyjmuje dwa elektrony, tworząc jony o ładunku -2. Jego wartościowość wynosi zazwyczaj II. Siarka, selen, tellur i polon mogą wykazywać wartościowość II, IV i VI.
-
Grupa 17 (halogeny): Pierwiastki tej grupy (fluor, chlor, brom, jod, astat) mają siedem elektronów walencyjnych. Fluor zawsze przyjmuje jeden elektron, tworząc jony o ładunku -1. Jego wartościowość wynosi zawsze I. Pozostałe halogeny mogą wykazywać wartościowość I, III, V i VII.
-
Grupa 18 (helowce, gazy szlachetne): Pierwiastki tej grupy (hel, neon, argon, krypton, ksenon, radon) mają osiem elektronów walencyjnych (z wyjątkiem helu, który ma dwa). Zazwyczaj są one bardzo niereaktywne, ponieważ mają pełną powłokę elektronową. Dawniej uważano, że ich wartościowość wynosi 0, ale niektóre z nich, zwłaszcza ksenon i krypton, mogą tworzyć związki z fluorem i tlenem, wykazując wartościowość II, IV, VI i VIII.
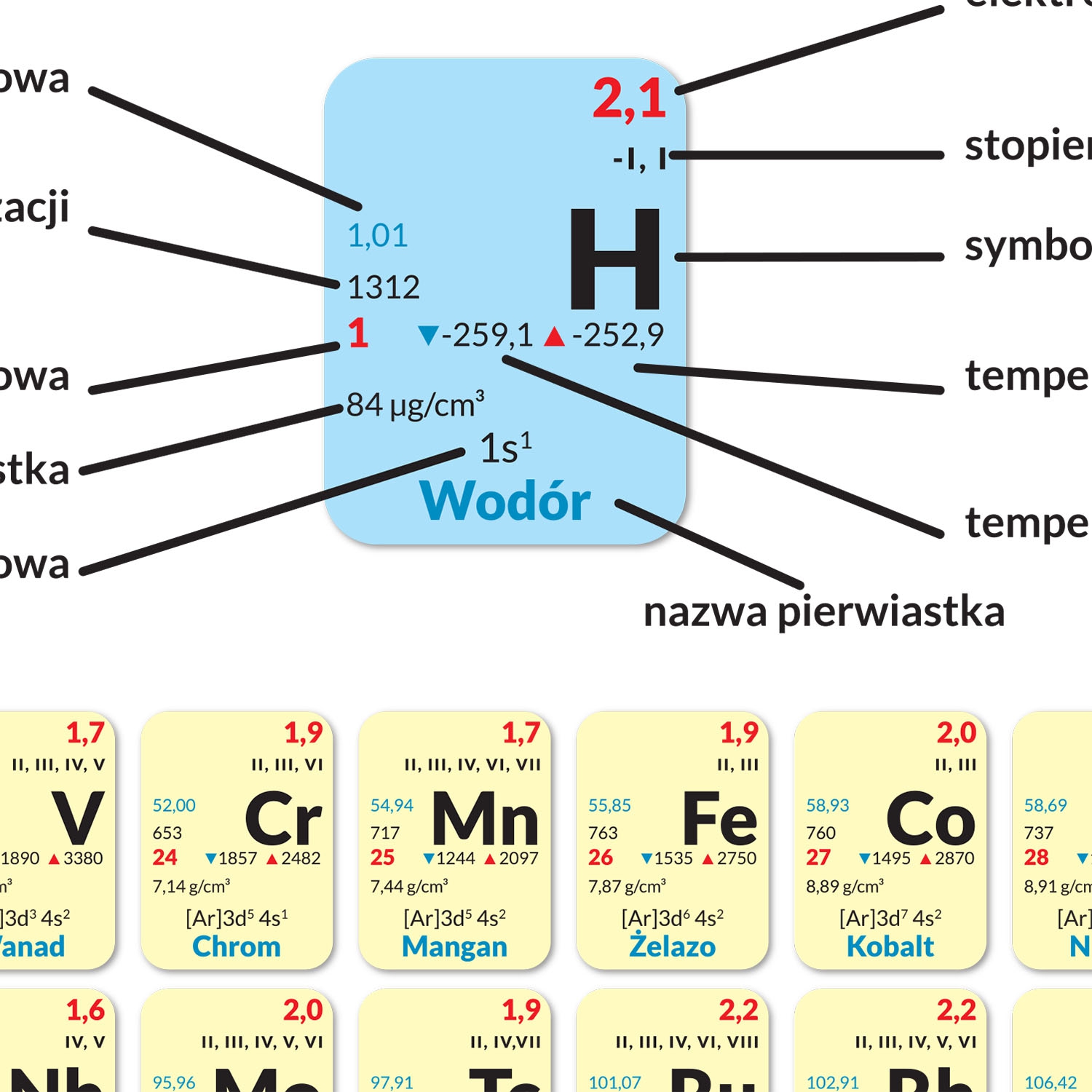
Pierwiastki przejściowe (grupy 3-12):
Wartościowość pierwiastków przejściowych jest bardziej skomplikowana i trudniejsza do przewidzenia na podstawie samego układu okresowego. Wynika to z faktu, że pierwiastki te mogą tracić elektrony z różnych poziomów energetycznych, a nie tylko z najbardziej zewnętrznej powłoki. Wiele z nich wykazuje zmienną wartościowość.
-
Żelazo (Fe): Najczęściej występuje w stopniach utlenienia +2 (Fe2+) i +3 (Fe3+), czyli wykazuje wartościowość II i III.
-
Miedź (Cu): Występuje w stopniach utlenienia +1 (Cu+) i +2 (Cu2+), czyli wykazuje wartościowość I i II.
-
Chrom (Cr): Występuje w stopniach utlenienia +2, +3 i +6, czyli wykazuje wartościowość II, III i VI.
Aby określić wartościowość pierwiastka przejściowego w konkretnym związku, należy posłużyć się kilkoma zasadami:
- Suma algebraiczna wartościowości wszystkich atomów w cząsteczce musi być równa zero (dla związków obojętnych).
- Wartościowość jonu prostego jest równa jego ładunkowi (np. Na+ ma wartościowość I, Cl- ma wartościowość I).
- Wartościowość tlenu w większości związków wynosi -2 (czyli wartościowość II).
- Wartościowość wodoru w większości związków wynosi +1 (czyli wartościowość I).
Przykłady zastosowania:
Załóżmy, że chcemy określić wartościowość manganu (Mn) w związku KMnO4 (manganian(VII) potasu).
- Wiemy, że potas (K) należy do grupy 1 i ma wartościowość I (+1).
- Wiemy, że tlen (O) ma wartościowość II (-2).
- W związku KMnO4 mamy jeden atom potasu, jeden atom manganu i cztery atomy tlenu.
- Suma wartościowości wszystkich atomów musi wynosić zero.
Równanie: (+1) + x + 4*(-2) = 0, gdzie x to wartościowość manganu.
Rozwiązując równanie, otrzymujemy: x = +7.
Zatem wartościowość manganu w KMnO4 wynosi VII.
Inny przykład: Określenie wartościowości siarki (S) w kwasie siarkowym(VI) H2SO4.
- Wodór (H) ma wartościowość I (+1).
- Tlen (O) ma wartościowość II (-2).
- Mamy dwa atomy wodoru, jeden atom siarki i cztery atomy tlenu.
Równanie: 2*(+1) + x + 4*(-2) = 0, gdzie x to wartościowość siarki.
Rozwiązując równanie, otrzymujemy: x = +6.
Zatem wartościowość siarki w H2SO4 wynosi VI.
Wartościowość a stopień utlenienia:
Choć terminy "wartościowość" i "stopień utlenienia" są często używane zamiennie, nie są one do końca synonimami. Wartościowość odnosi się do liczby wiązań, które atom może utworzyć, natomiast stopień utlenienia jest formalnym ładunkiem, który atom miałby, gdyby wszystkie wiązania były jonowe. Stopień utlenienia może być dodatni, ujemny lub zerowy, podczas gdy wartościowość jest zawsze liczbą dodatnią (lub zerem, w przypadku gazów szlachetnych). Dla wielu pierwiastków w prostych związkach, wartościowość i stopień utlenienia są liczbowo równe (pomijając znak).
Podsumowując, odczytywanie wartościowości pierwiastków z układu okresowego wymaga zrozumienia konfiguracji elektronowej i położenia danego pierwiastka w układzie. Dla pierwiastków grup głównych, wartościowość można przewidzieć na podstawie numeru grupy. Dla pierwiastków przejściowych, konieczna jest znajomość zasad obliczania wartościowości w związkach chemicznych oraz zapamiętanie najczęstszych wartościowości.