Jak Odczytać Wartościowość Pierwiastków Z Układu Okresowego

Hej wszystkim! Często pytacie, jak odczytywać wartościowość pierwiastków z układu okresowego. Postaram się to wytłumaczyć w prosty sposób. To wcale nie jest takie trudne, jak się wydaje!
Na początek, czym w ogóle jest ta nieszczęsna wartościowość? Mówiąc najprościej, wartościowość pierwiastka to liczba wiązań, jakie ten pierwiastek tworzy z innymi atomami. Wyobraźcie sobie, że wartościowość to liczba rąk, które atom ma do dyspozycji, żeby "chwycić" inne atomy.
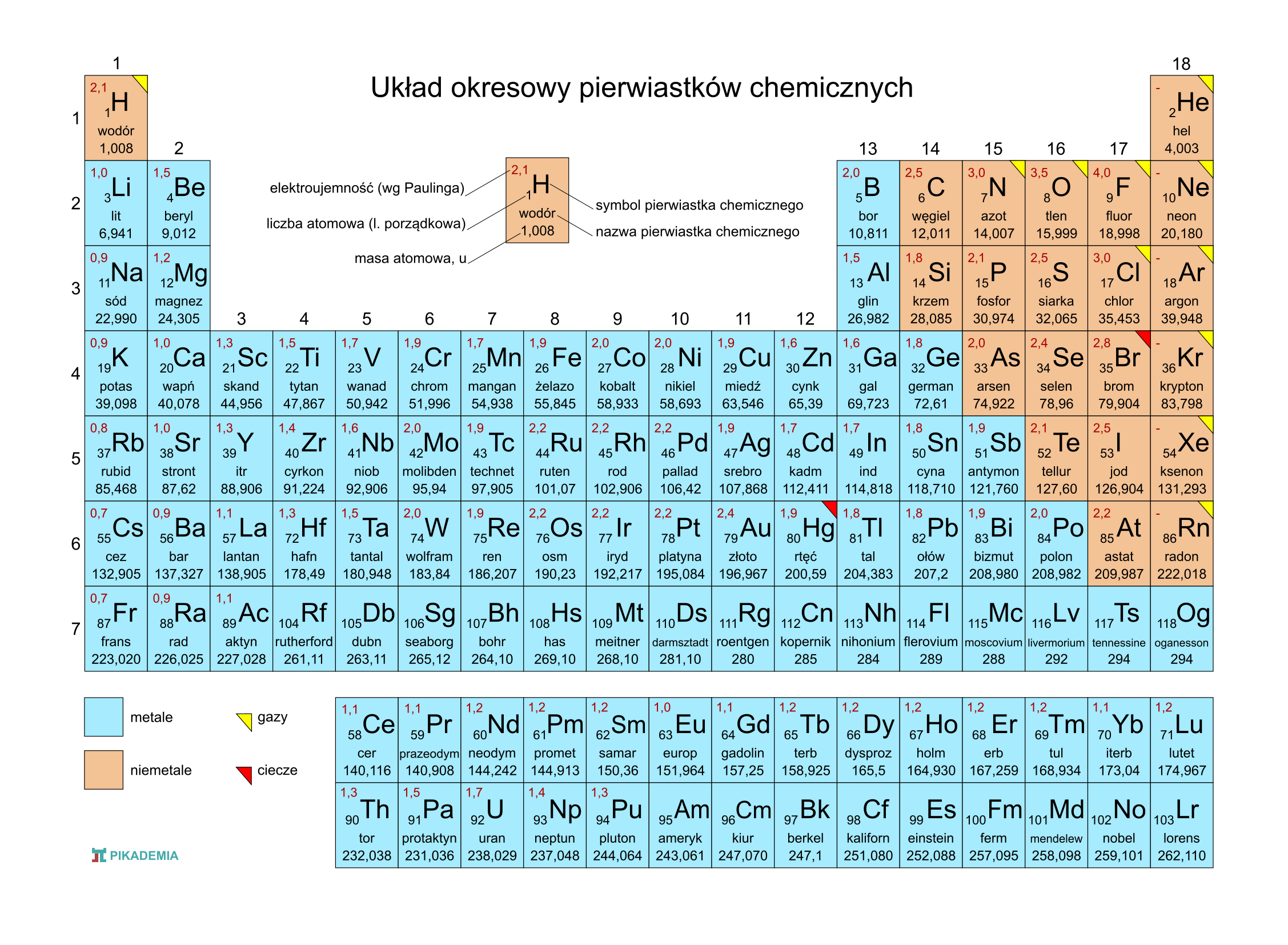
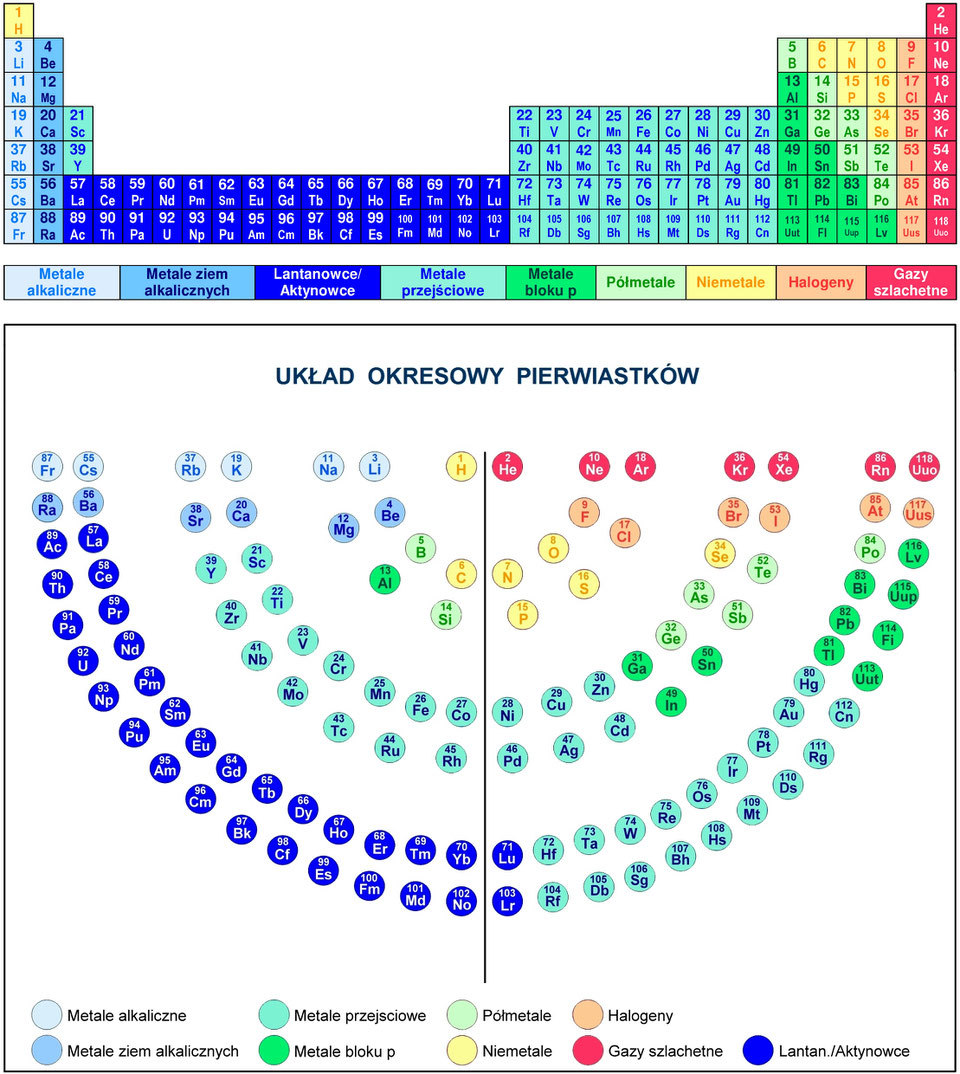
Teraz, jak to odczytać z układu okresowego? Układ okresowy jest tak skonstruowany, że wiele informacji jest w nim ukrytych, trzeba tylko wiedzieć, gdzie szukać.
Pierwsza sprawa: spójrzcie na grupy (czyli kolumny) w układzie okresowym. Numer grupy często podpowiada nam, jaka jest wartościowość pierwiastków w tej grupie. Ale uwaga! Nie zawsze tak jest, bo chemia lubi niespodzianki!
Grupa 1 (litowce): Te pierwiastki mają zazwyczaj wartościowość I. Czyli tworzą jedno wiązanie. Przykład: sód (Na) w chlorku sodu (NaCl) ma wartościowość I.
Grupa 2 (berylowce): Tutaj mamy wartościowość II. Przykład: magnez (Mg) w tlenku magnezu (MgO) ma wartościowość II.
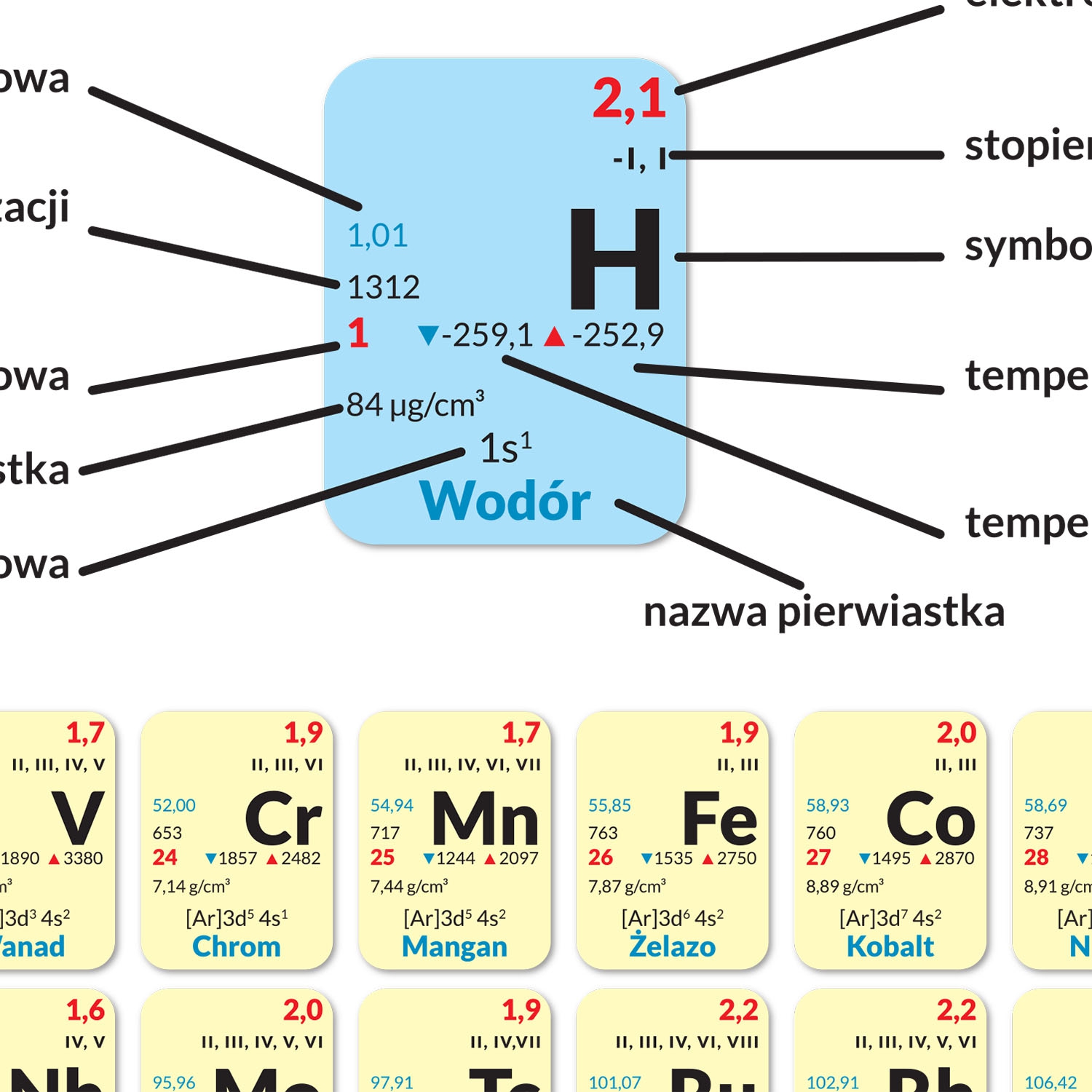
Teraz robi się trochę bardziej skomplikowanie. Grupy od 3 do 12 (metale przejściowe) to już trochę inna bajka. Metale przejściowe często mają kilka różnych wartościowości. Trzeba patrzeć na konkretny związek, żeby to ustalić. Na przykład żelazo (Fe) może mieć wartościowość II (np. w chlorku żelaza(II) – FeCl₂) lub III (np. w chlorku żelaza(III) – FeCl₃). Nie martwcie się, zaraz powiem, jak to ustalić w takich przypadkach.
Grupa 13 (borowce): Zazwyczaj wartościowość III. Przykład: glin (Al) w tlenku glinu (Al₂O₃) ma wartościowość III.
Grupa 14 (węglowce): Tutaj mamy pewien problem, bo węgiel (C) i krzem (Si) najczęściej mają wartościowość IV, ale bywają wyjątki. Na przykład w tlenku węgla(II) (CO) węgiel ma wartościowość II.
Grupa 15 (azotowce): Azot (N) i fosfor (P) są kapryśne. Mogą mieć wartościowość III lub V, a czasami nawet inną! Trzeba patrzeć na konkretny związek. Na przykład azot w amoniaku (NH₃) ma wartościowość III, a w tlenku azotu(V) (N₂O₅) ma wartościowość V.
Grupa 16 (tlenowce): Tlen (O) zazwyczaj ma wartościowość II. To bardzo ważna informacja! Pamiętajcie o tym. Siarka (S) jest bardziej zmienna – może mieć wartościowość II, IV lub VI.
Grupa 17 (halogenowce): Fluor (F) zawsze ma wartościowość I. To kolejny pewniak! Pozostałe halogenowce (chlor, brom, jod) zazwyczaj mają wartościowość I, ale mogą mieć też wyższe wartościowości (III, V, VII), szczególnie w związkach z tlenem.
Grupa 18 (helowce, gazy szlachetne): Te pierwiastki są bardzo stabilne i rzadko tworzą wiązania. Zazwyczaj uznaje się, że mają wartościowość 0. Ale w niektórych, specyficznych warunkach, niektóre gazy szlachetne (np. ksenon) mogą tworzyć związki.
Jak ustalić wartościowość, gdy nie jest to oczywiste?
Ok, wiemy już, że nie zawsze numer grupy podpowiada nam wartościowość. Co wtedy? Najważniejsza zasada: suma wartościowości wszystkich atomów w cząsteczce musi być równa zero (jeśli cząsteczka jest obojętna, czyli nie ma ładunku). A jeśli mamy jon, to suma wartościowości musi być równa ładunkowi jonu.
Weźmy na przykład wspomniany wcześniej chlorek żelaza(III) (FeCl₃). Wiemy, że chlor (Cl) jest w grupie 17 i zazwyczaj ma wartościowość I. Skoro mamy trzy atomy chloru, to łącznie dają one -3 (bo chlor jest elektroujemny i ma wartościowość -I). Żeby cząsteczka była obojętna, żelazo (Fe) musi mieć wartościowość +III.
Inny przykład: siarczan(VI) sodu (Na₂SO₄). Wiemy, że sód (Na) ma wartościowość I i mamy dwa atomy sodu, czyli łącznie +2. Tlen (O) ma wartościowość II i mamy cztery atomy tlenu, czyli łącznie -8. Żeby to wszystko się zrównoważyło, siarka (S) musi mieć wartościowość +VI (bo +2 + VI - 8 = 0).
Kolejna sprawa: nauczcie się na pamięć wartościowości niektórych popularnych grup atomów, czyli tzw. reszt kwasowych. Na przykład grupa siarczanowa (SO₄) ma zawsze ładunek -2, grupa azotanowa (NO₃) ma ładunek -1, grupa fosforanowa (PO₄) ma ładunek -3. To bardzo ułatwia ustalanie wartościowości w bardziej skomplikowanych związkach.
I jeszcze jedna wskazówka: pamiętajcie, że wodór (H) zazwyczaj ma wartościowość I (czyli tworzy jedno wiązanie).
Ćwiczenie czyni mistrza!
Najlepszy sposób na opanowanie wartościowości to po prostu ćwiczyć. Weźcie kartkę, długopis i układ okresowy i zacznijcie analizować różne związki. Ustalajcie wartościowości poszczególnych pierwiastków. Sprawdzajcie w internecie, czy dobrze to robicie. Im więcej będziecie ćwiczyć, tym łatwiej wam to przyjdzie.
Pamiętajcie też, że chemia to nie tylko suche reguły i wzory. To przede wszystkim ciekawość i chęć zrozumienia, jak działa świat. Nie zrażajcie się trudnościami i nie bójcie się pytać!
Podsumowując, odczytywanie wartościowości z układu okresowego to umiejętność, którą można opanować. Zacznijcie od zapamiętania wartościowości dla grup 1, 2, 16 i 17. Potem nauczcie się ustalać wartościowości w konkretnych związkach, korzystając z zasady, że suma wartościowości musi być równa zero. I przede wszystkim – ćwiczcie! Powodzenia!