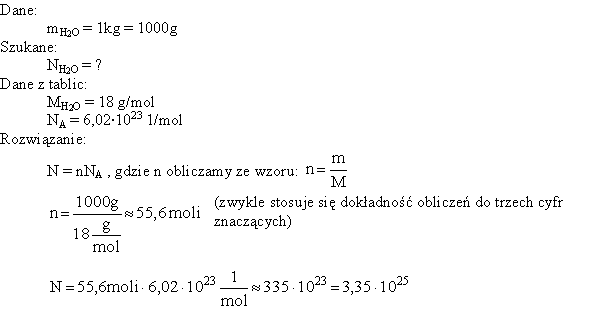Jak Obliczyć Masę Substancji

Czy kiedykolwiek zastanawiałeś się, jak dokładnie odmierzyć składniki do ulubionego przepisu? Albo jak obliczyć, ile nawozu potrzebujesz, aby Twój ogród pięknie kwitł? A może w laboratorium, gdzie precyzja to podstawa, musisz przygotować roztwór o ściśle określonym stężeniu? W każdym z tych przypadków – i w wielu innych – kluczowe jest umiejętne obliczanie masy substancji. Może to brzmieć skomplikowanie, ale uwierz mi, z odpowiednim podejściem i prostymi narzędziami, to zadanie staje się zaskakująco proste i niezwykle przydatne.
Wiem, że dla wielu osób chemia i obliczenia mogą budzić niepokój. W szkole wzory wydawały się niezrozumiałe, a zadania – bezsensowne. Pamiętam, sam miałem z tym problem! Ale chcę Ci pokazać, że zrozumienie podstawowych zasad i nauczenie się kilku prostych metod może otworzyć Ci drzwi do świata, w którym masa substancji przestaje być tajemnicą, a staje się narzędziem w Twoich rękach.
Dlaczego obliczanie masy substancji jest tak ważne?
Zanim przejdziemy do konkretnych metod, warto zrozumieć, dlaczego w ogóle zawracamy sobie tym głowę. Odpowiedź jest prosta: masa substancji wpływa na wszystko!
- W kuchni: Zbyt dużo soli zepsuje danie. Zbyt mało cukru sprawi, że ciasto będzie mdłe. Precyzyjne odmierzanie składników to gwarancja smacznego i powtarzalnego efektu.
- W ogrodnictwie: Odpowiednia dawka nawozu zapewni roślinom zdrowy wzrost. Nadmiar może je spalić i zniszczyć.
- W medycynie: Dawkowanie leków musi być niezwykle precyzyjne. Za duża dawka może być toksyczna, za mała – nieskuteczna.
- W przemyśle: W produkcji chemikaliów, kosmetyków, a nawet materiałów budowlanych, proporcje składników muszą być ściśle kontrolowane, aby zapewnić jakość i bezpieczeństwo produktu.
Wyobraź sobie, że chcesz przygotować roztwór soli fizjologicznej do przemywania ran. Niby nic trudnego, ale niewłaściwe stężenie może podrażnić ranę zamiast ją oczyścić. Zatem zrozumienie, jak obliczyć masę substancji, to nie tylko teoretyczna wiedza, ale realna umiejętność, która wpływa na nasze życie codzienne.
Metody obliczania masy substancji
Istnieje kilka podstawowych metod obliczania masy substancji, w zależności od tego, co wiemy i czego szukamy. Przyjrzyjmy się najpopularniejszym z nich:
1. Korzystanie ze wzoru na gęstość
Gęstość to masa substancji zawarta w jednostce objętości. Mówiąc prościej, to ile "waży" litr danego płynu lub substancji. Wzór na gęstość wygląda następująco:
d = m / V
Gdzie:
- d - gęstość (zwykle wyrażana w g/cm3 lub kg/m3)
- m - masa (zwykle wyrażana w gramach (g) lub kilogramach (kg))
- V - objętość (zwykle wyrażana w centymetrach sześciennych (cm3) lub metrach sześciennych (m3) lub litrach (L))
Jeśli znamy gęstość substancji i jej objętość, możemy łatwo obliczyć jej masę, przekształcając wzór:
m = d * V
Przykład: Chcemy obliczyć masę 250 ml wody. Wiemy, że gęstość wody wynosi około 1 g/ml.
Zatem: m = 1 g/ml * 250 ml = 250 g
Pamiętaj o zachowaniu spójności jednostek! Jeśli gęstość jest podana w kg/m3, objętość również musi być wyrażona w m3.
2. Korzystanie z masy molowej
Masa molowa to masa jednego mola substancji. Mol to jednostka ilości materii, zawierająca 6.022 x 1023 atomów, cząsteczek lub jonów (liczba Avogadro). Masa molowa jest wyrażana w gramach na mol (g/mol) i można ją odczytać z układu okresowego pierwiastków dla pojedynczych atomów lub obliczyć dla związków chemicznych sumując masy molowe wszystkich atomów wchodzących w skład cząsteczki.
Aby obliczyć masę substancji, potrzebujemy znać jej liczbę moli (n) i masę molową (M):
m = n * M
Przykład: Chcemy obliczyć masę 0.5 mola chlorku sodu (NaCl).
Masa molowa Na (sodu) wynosi około 23 g/mol, a Cl (chloru) około 35.5 g/mol.
Zatem masa molowa NaCl wynosi: 23 g/mol + 35.5 g/mol = 58.5 g/mol
m = 0.5 mol * 58.5 g/mol = 29.25 g
3. Korzystanie ze stężenia roztworu
Stężenie roztworu określa ilość substancji rozpuszczonej w danej ilości roztworu. Istnieją różne rodzaje stężeń, ale najczęściej spotykane to:
- Stężenie procentowe masowe (cp): wyraża masę substancji w gramach na 100 gram roztworu.
- Stężenie molowe (cm): wyraża liczbę moli substancji rozpuszczonej w 1 litrze roztworu.
Obliczanie masy substancji na podstawie stężenia procentowego masowego:
Jeśli znamy stężenie procentowe masowe (cp) i masę roztworu (mr), możemy obliczyć masę substancji (ms):
ms = (cp / 100) * mr
Przykład: Mamy 200 g roztworu soli o stężeniu 10%. Ile gramów soli znajduje się w tym roztworze?
ms = (10 / 100) * 200 g = 20 g
Obliczanie masy substancji na podstawie stężenia molowego:
Jeśli znamy stężenie molowe (cm) i objętość roztworu (V) w litrach, możemy obliczyć liczbę moli substancji (n):
n = cm * V
Następnie, znając liczbę moli i masę molową (M), obliczamy masę substancji (m) jak w punkcie 2:
m = n * M
Przykład: Mamy 0.5 litra roztworu NaOH (wodorotlenku sodu) o stężeniu 2 mol/l. Ile gramów NaOH znajduje się w tym roztworze?
n = 2 mol/l * 0.5 l = 1 mol
Masa molowa NaOH wynosi: 23 g/mol (Na) + 16 g/mol (O) + 1 g/mol (H) = 40 g/mol
m = 1 mol * 40 g/mol = 40 g
Co, jeśli nie znam gęstości lub masy molowej?
To naturalne pytanie! Co zrobić, gdy nie mamy wszystkich danych potrzebnych do obliczeń? W takim przypadku możemy:
- Poszukać danych w literaturze: Gęstości i masy molowe wielu substancji są dostępne w podręcznikach, encyklopediach chemicznych, a także w internecie (np. w kartach charakterystyki substancji).
- Przeprowadzić eksperyment: Jeśli potrzebujemy gęstości nieznanej substancji, możemy zmierzyć jej masę i objętość, a następnie obliczyć gęstość za pomocą wzoru d = m / V.
Czy obliczanie masy substancji zawsze musi być idealne?
W idealnym świecie, tak. Ale w rzeczywistości, pewna doza błędu jest nieunikniona. Błędy mogą wynikać z niedokładności pomiarów, niedoskonałości sprzętu laboratoryjnego, a nawet z zaokrągleń podczas obliczeń. Dlatego ważne jest, aby:
- Używać precyzyjnych narzędzi pomiarowych: Im dokładniejsza waga i kolba miarowa, tym mniejsze ryzyko błędu.
- Powtarzać pomiary: Wykonanie kilku pomiarów i obliczenie średniej wartości pomoże zminimalizować wpływ błędów przypadkowych.
- Zwracać uwagę na jednostki: Upewnij się, że wszystkie jednostki są spójne przed rozpoczęciem obliczeń.
- Oceniać niepewność pomiarową: W bardziej zaawansowanych obliczeniach, warto uwzględnić niepewność pomiarową, czyli zakres, w którym może mieścić się prawdziwa wartość.
Niektórzy mogą argumentować, że w życiu codziennym taka precyzja nie jest konieczna. To prawda, że w kuchni niewielkie odstępstwa od przepisu nie zawsze zepsują potrawę. Jednak świadomość potencjalnych źródeł błędów i dążenie do jak największej dokładności zawsze są korzystne.
Podsumowanie i dalsze kroki
Obliczanie masy substancji to umiejętność niezwykle przydatna w wielu dziedzinach życia, od kuchni i ogrodnictwa po medycynę i przemysł. Poznanie podstawowych wzorów i metod, takich jak korzystanie z gęstości, masy molowej i stężenia roztworów, otwiera drzwi do świata, w którym możemy precyzyjnie kontrolować ilości substancji, z którymi pracujemy.
Nie zrażaj się, jeśli na początku wydaje Ci się to skomplikowane. Ćwiczenie czyni mistrza! Spróbuj rozwiązać kilka prostych zadań, a zobaczysz, że z czasem obliczanie masy substancji stanie się dla Ciebie intuicyjne i proste.
Czy masz jakieś pytania dotyczące obliczania masy substancji? A może masz własne triki i porady, którymi chciałbyś się podzielić?