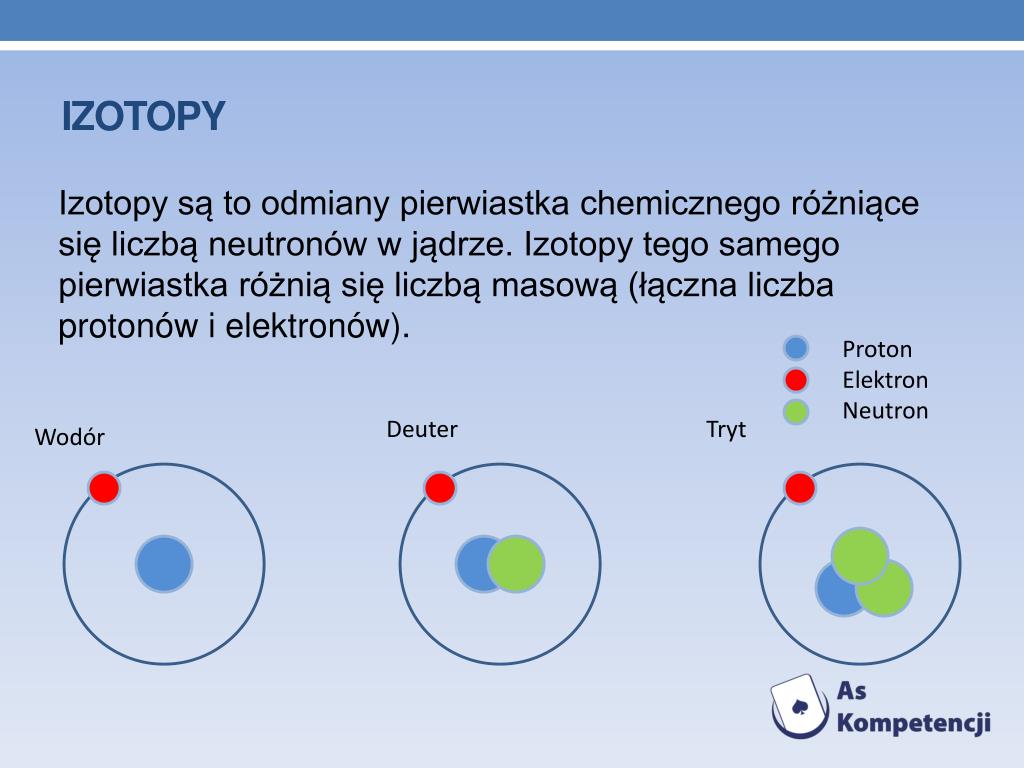
Izotopy Pierwiastka Chemicznego Maja Taka Sama Liczbe
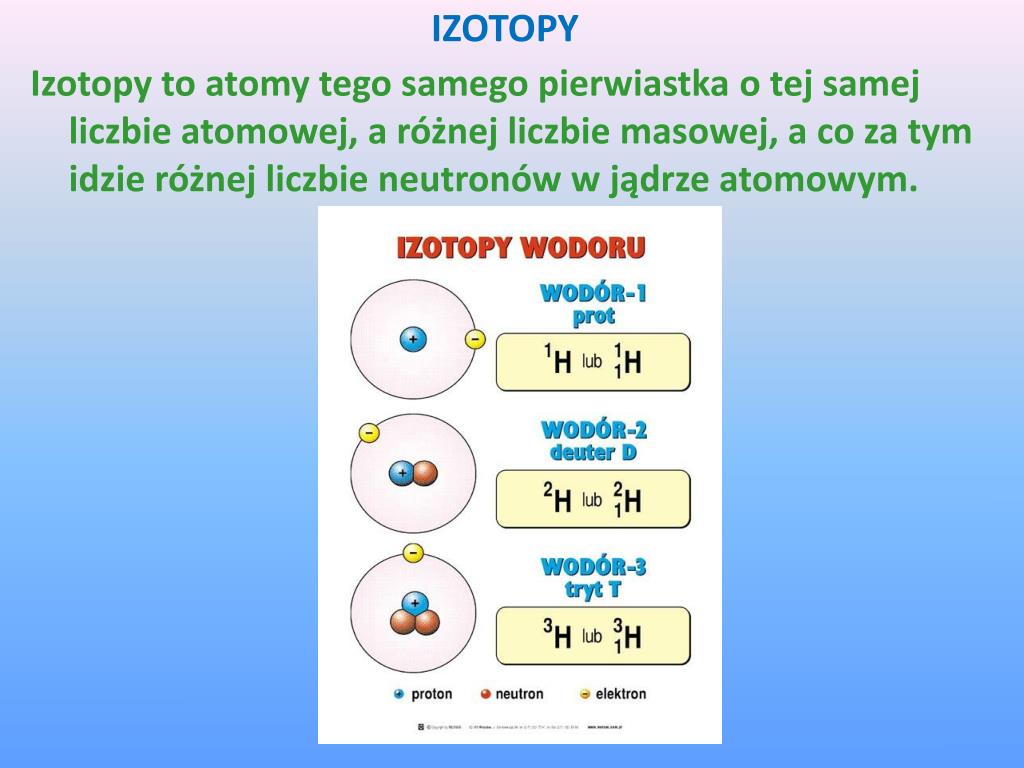
Izotopy to temat, który często pojawia się na lekcjach chemii i fizyki. Chociaż może brzmieć skomplikowanie, w rzeczywistości zrozumienie izotopów jest całkiem proste, jeśli podejdziemy do tego krok po kroku. Spójrzmy na to, co sprawia, że izotopy są tak interesujące i jakie właściwości je charakteryzują.
Zacznijmy od podstaw. Każdy pierwiastek chemiczny, taki jak węgiel, tlen czy żelazo, składa się z atomów. Atom z kolei zbudowany jest z trzech podstawowych składników: protonów, neutronów i elektronów. Protony i neutrony znajdują się w jądrze atomowym, czyli centralnej części atomu, natomiast elektrony krążą wokół jądra.
Liczba Atomowa i Liczba Masowa
Kluczowe dla zrozumienia izotopów są dwie liczby: liczba atomowa i liczba masowa. Liczba atomowa to liczba protonów w jądrze atomowym. To właśnie liczba protonów decyduje, jakim pierwiastkiem jest dany atom. Na przykład, każdy atom, który ma 6 protonów, to atom węgla. Liczba atomowa węgla to zatem 6. Zawsze. Nie ma od tego wyjątków.
Liczba masowa to suma liczby protonów i neutronów w jądrze atomowym. Dlatego, jeśli wiemy, że atom węgla ma 6 protonów i 6 neutronów, to jego liczba masowa wynosi 12. Jeśli natomiast inny atom węgla ma 6 protonów, ale 8 neutronów, to jego liczba masowa wynosi 14.
Teraz dochodzimy do sedna: czym są izotopy? Izotopy to atomy tego samego pierwiastka, czyli mają tą samą liczbę protonów, ale różnią się liczbą neutronów. Ponieważ liczba protonów decyduje o tym, jaki to pierwiastek, wszystkie izotopy danego pierwiastka to nadal ten sam pierwiastek, ale o różnej masie atomowej.
Weźmy jeszcze raz przykład węgla. Węgiel występuje w przyrodzie w różnych formach, a najpopularniejsze z nich to węgiel-12 (oznaczany jako ¹²C) i węgiel-14 (oznaczany jako ¹⁴C). Oba te atomy mają 6 protonów, ponieważ są węglem. Jednak węgiel-12 ma 6 neutronów (6 protonów + 6 neutronów = liczba masowa 12), a węgiel-14 ma 8 neutronów (6 protonów + 8 neutronów = liczba masowa 14). To właśnie różnica w liczbie neutronów sprawia, że są to różne izotopy tego samego pierwiastka.
Zastanówmy się teraz, co ta różnica w liczbie neutronów oznacza dla właściwości izotopów. Generalnie, izotopy danego pierwiastka mają bardzo podobne właściwości chemiczne. Dzieje się tak, ponieważ właściwości chemiczne atomu są w dużej mierze determinowane przez liczbę elektronów, a liczba elektronów jest z kolei równa liczbie protonów (w neutralnym atomie). Zatem, ponieważ izotopy mają tą samą liczbę protonów, mają również tą samą liczbę elektronów i podobne zachowanie chemiczne.
Jednak różnica w liczbie neutronów wpływa na masę atomową izotopu, co może mieć wpływ na pewne właściwości fizyczne, takie jak gęstość czy szybkość dyfuzji. Ponadto, niektóre izotopy są stabilne, czyli ich jądra atomowe nie ulegają rozpadowi, natomiast inne są niestabilne i ulegają rozpadowi promieniotwórczemu. Węgiel-14, o którym wspomnieliśmy, jest izotopem niestabilnym, co oznacza, że jego jądro atomowe z czasem ulega rozpadowi. Ten proces rozpadu promieniotwórczego jest wykorzystywany w datowaniu radiowęglowym, które pozwala określić wiek obiektów organicznych, takich jak drewno, kości czy tkaniny.
Przykłady Izotopów Innych Pierwiastków
Węgiel to tylko jeden z przykładów pierwiastka, który ma izotopy. Wiele innych pierwiastków również występuje w formie różnych izotopów.
- Wodór: Wodór ma trzy główne izotopy: prot (¹H), deuter (²H) i tryt (³H). Prot ma tylko jeden proton, deuter ma jeden proton i jeden neutron, a tryt ma jeden proton i dwa neutrony. Tryt jest izotopem promieniotwórczym.
- Tlen: Tlen ma kilka izotopów, w tym tlen-16 (¹⁶O), tlen-17 (¹⁷O) i tlen-18 (¹⁸O). Tlen-16 jest najczęściej występującym izotopem tlenu.
- Uran: Uran ma dwa główne izotopy: uran-235 (²³⁵U) i uran-238 (²³⁸U). Uran-235 jest wykorzystywany w elektrowniach jądrowych i broni jądrowej, ponieważ ulega rozszczepieniu jądrowemu.
Zastosowania Izotopów
Izotopy mają szerokie zastosowanie w różnych dziedzinach nauki, medycyny i przemysłu.
- Medycyna: Izotopy promieniotwórcze są wykorzystywane w diagnostyce i leczeniu chorób. Na przykład, jod-131 (¹³¹I) jest stosowany w leczeniu chorób tarczycy, a technet-99m (⁹⁹ᵐTc) jest używany w obrazowaniu medycznym.
- Archeologia: Jak już wspomniano, węgiel-14 jest wykorzystywany w datowaniu radiowęglowym, które pozwala określić wiek obiektów organicznych.
- Geologia: Izotopy strontu, rubidu i innych pierwiastków są wykorzystywane do datowania skał i minerałów, co pozwala geologom zrozumieć historię Ziemi.
- Przemysł: Izotopy są wykorzystywane w radiografii przemysłowej do sprawdzania jakości spawów i innych materiałów.
Podsumowując, izotopy to atomy tego samego pierwiastka, które mają tą samą liczbę protonów, ale różną liczbę neutronów. To właśnie ta różnica w liczbie neutronów sprawia, że izotopy mają różne masy atomowe i mogą wykazywać różnice w niektórych właściwościach fizycznych. Izotopy znajdują szerokie zastosowanie w różnych dziedzinach, od medycyny po archeologię i geologię, co pokazuje, jak ważne jest zrozumienie tego pojęcia. Mam nadzieję, że teraz temat izotopów jest dla Ciebie jaśniejszy!