Ile Atomow Ma Czasteczka Wody
Woda, substancja niezbędna dla życia na Ziemi, jest powszechnie znana, ale czy kiedykolwiek zastanawiałeś się, z czego dokładnie się składa? Ten artykuł szczegółowo wyjaśni budowę cząsteczki wody, koncentrując się na liczbie i rodzaju atomów, które ją tworzą. Zrozumienie tej prostej, a zarazem fundamentalnej struktury jest kluczowe do pojęcia wielu procesów chemicznych i biologicznych.
Skład Chemiczny Wody: Podstawy
Cząsteczka wody, oznaczana wzorem chemicznym H2O, składa się z dwóch rodzajów atomów: wodoru (H) i tlenu (O). Liczba atomów w jednej cząsteczce wody jest stała: dwa atomy wodoru i jeden atom tlenu. To właśnie ta specyficzna kombinacja nadaje wodzie jej unikalne właściwości.
Wzór Strukturalny i Wiązania
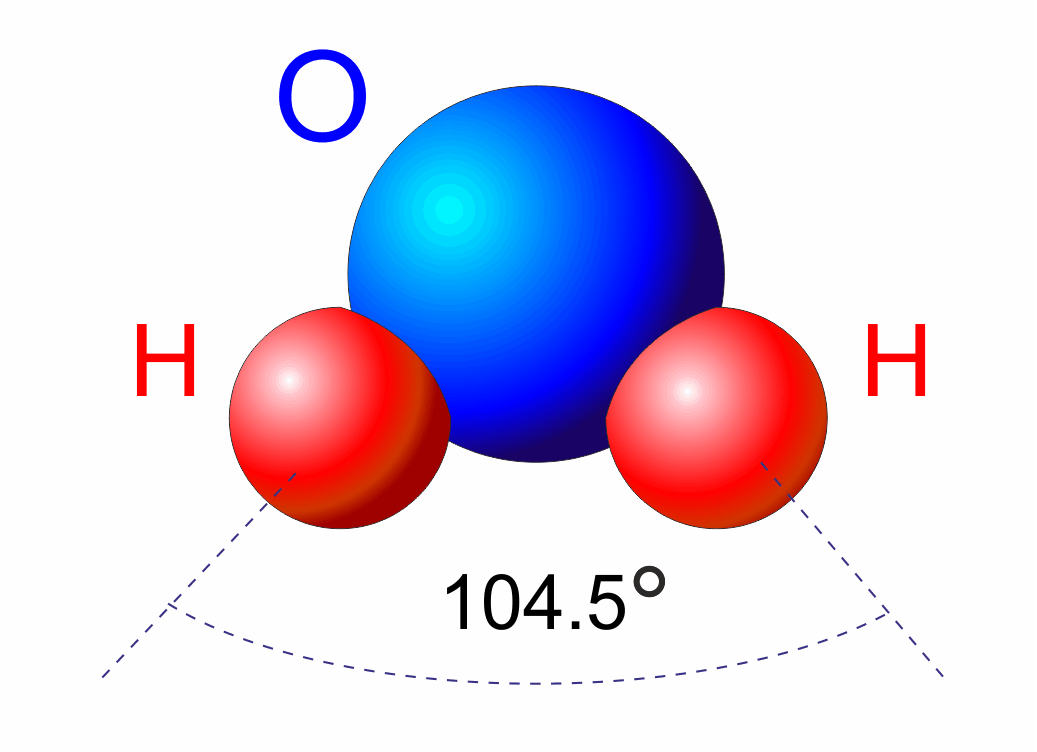
Wzór strukturalny wody nie jest liniowy. Atomy wodoru są połączone z atomem tlenu pod kątem około 104.5 stopni. Taki układ wynika z hybrydyzacji orbitali atomowych tlenu i obecności dwóch wolnych par elektronowych na atomie tlenu, które odpychają wiązania O-H. Wiązania między atomami wodoru a tlenu są kowalencyjne spolaryzowane. Oznacza to, że elektrony nie są współdzielone równo; atom tlenu przyciąga elektrony silniej niż atomy wodoru. To powoduje, że atom tlenu uzyskuje częściowy ładunek ujemny (δ-), a atomy wodoru zyskują częściowy ładunek dodatni (δ+).
Wpływ Polarności na Właściwości Wody
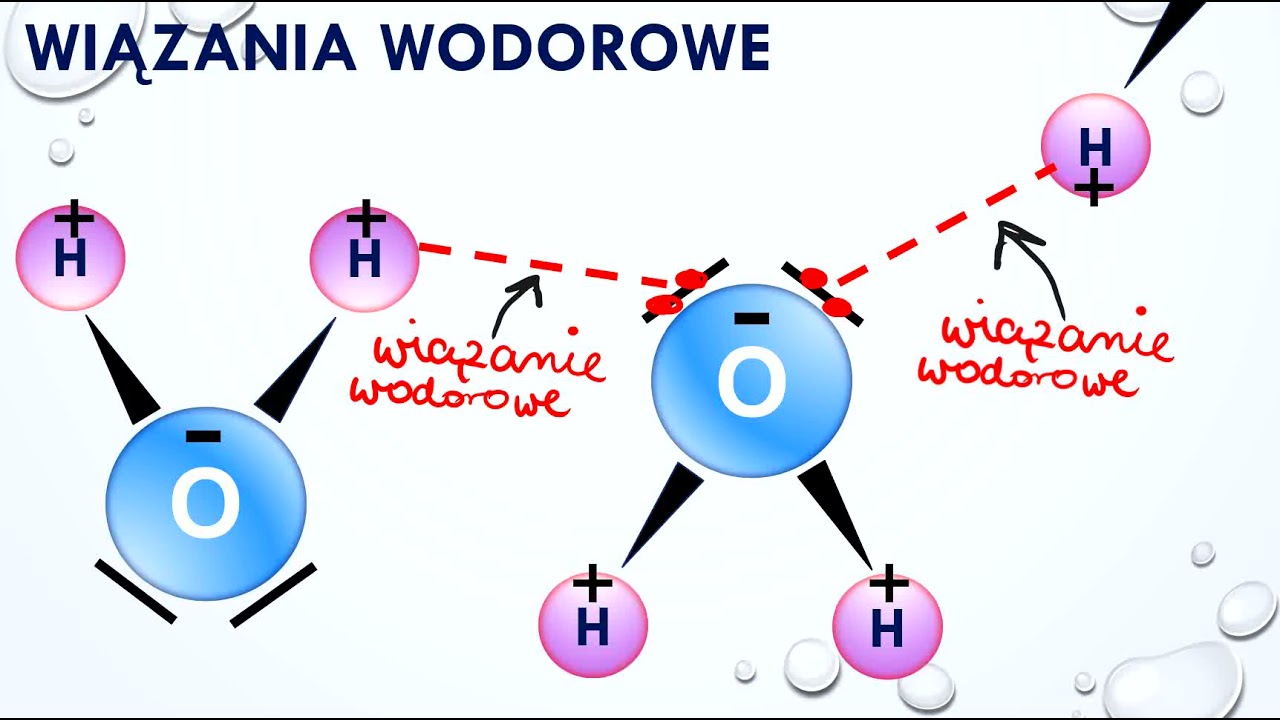
Polarność cząsteczki wody jest kluczowa dla jej unikalnych właściwości. Dzięki niej cząsteczki wody tworzą wiązania wodorowe między sobą. Atom wodoru z jednej cząsteczki, obdarzony ładunkiem dodatnim, przyciąga atom tlenu z innej cząsteczki, obdarzony ładunkiem ujemnym. Te wiązania wodorowe są relatywnie słabe w porównaniu do wiązań kowalencyjnych, ale ich duża liczba nadaje wodzie niezwykłe cechy, takie jak wysokie napięcie powierzchniowe, wysokie ciepło właściwe i anomalną rozszerzalność podczas zamarzania.
Atomy Wodoru w Cząsteczce Wody
Wodór (H) jest najprostszym i najlżejszym pierwiastkiem w układzie okresowym. Jego atom składa się z jednego protonu w jądrze i jednego elektronu krążącego wokół jądra. W cząsteczce wody, dwa atomy wodoru łączą się kowalencyjnie z atomem tlenu. Jak już wspomniano, ze względu na różnicę elektroujemności, atomy wodoru w wodzie mają częściowy ładunek dodatni.
Rola Wodoru w Wiązaniach Wodorowych
Atom wodoru pełniący rolę donora wiązania wodorowego jest istotny dla stabilności struktur biologicznych, takich jak białka i DNA. Wiązania wodorowe utrzymują strukturę drugorzędową i trzeciorzędową białek, determinując ich funkcję. Podobnie, wiązania wodorowe między parami zasad azotowych w DNA zapewniają stabilność podwójnej helisy.
Atom Tlenu w Cząsteczce Wody
Tlen (O) jest pierwiastkiem bardziej elektroujemnym niż wodór. Oznacza to, że silniej przyciąga elektrony w wiązaniu kowalencyjnym. Atom tlenu w wodzie ma częściowy ładunek ujemny, co pozwala mu na tworzenie wiązań wodorowych z atomami wodoru innych cząsteczek wody.
Konfiguracja Elektronowa Tlenu i Kąt Wiązania
Konfiguracja elektronowa tlenu (1s2 2s2 2p4) wyjaśnia jego zdolność do tworzenia dwóch wiązań kowalencyjnych. Te wiązania skierowane są w przestrzeni, tworząc kąt około 104.5 stopni, co wynika z odpychania elektronów w orbitalach. Idealny kąt dla tetraedrycznej konfiguracji to 109.5 stopnia, ale wolne pary elektronowe na tlenie dodatkowo odpychają wiązania O-H, zmniejszając kąt między nimi.
Woda w Świecie Rzeczywistym: Przykłady i Dane
Wszechobecność wody w naszym świecie sprawia, że jej właściwości, wynikające z jej prostej budowy atomowej, mają ogromny wpływ na liczne zjawiska.
Wpływ na Klimat
Wysokie ciepło właściwe wody sprawia, że oceany i jeziora działają jak regulatory temperatury. Pochłaniają duże ilości ciepła bez znaczącej zmiany temperatury, co łagodzi wahania temperatury na Ziemi. Z kolei wysokie ciepło parowania wody jest istotne dla procesów chłodzenia, takich jak pocenie się u ludzi. Bez tych właściwości klimat Ziemi byłby znacznie bardziej ekstremalny.
Rola w Procesach Biologicznych
Woda jest rozpuszczalnikiem życia. Wiele reakcji biochemicznych zachodzi w środowisku wodnym. Woda transportuje substancje odżywcze i produkty przemiany materii w organizmach. Ponadto, woda jest substratem w wielu reakcjach metabolicznych, takich jak fotosynteza i oddychanie komórkowe.
Przykłady Danych: Gęstość i Napięcie Powierzchniowe
Gęstość wody (ok. 1 g/cm3) i jej zmiany w zależności od temperatury są nietypowe. Największą gęstość woda osiąga w temperaturze 4°C, a zmniejsza się, gdy temperatura spada poniżej tej wartości. To zjawisko sprawia, że lód pływa na wodzie, co jest kluczowe dla przetrwania organizmów wodnych w zimie. Napięcie powierzchniowe wody, wynoszące około 72 mN/m, pozwala owadom chodzić po powierzchni wody i jest ważne dla kapilarności w roślinach.
Podsumowanie i Dalsze Kroki
Podsumowując, cząsteczka wody, składająca się z dwóch atomów wodoru i jednego atomu tlenu (H2O), ma unikalną strukturę, która nadaje jej niezwykłe właściwości. Polarność cząsteczki i tworzenie wiązań wodorowych są kluczowe dla jej roli w biologii, chemii i klimacie.
Aby poszerzyć wiedzę na temat wody, warto zgłębić zagadnienia takie jak: wiązania wodorowe w kontekście innych substancji, wpływ zanieczyszczeń na właściwości wody, oraz zastosowanie wody w przemyśle i technologii. Zrozumienie budowy i właściwości wody jest fundamentem dla zrozumienia wielu procesów zachodzących w naszym otoczeniu.
Mam nadzieję, że ten artykuł rzucił nowe światło na budowę cząsteczki wody. Zachęcam do dalszego eksplorowania fascynującego świata chemii i biologii!