Gdzie Jest Okres A Gdzie Grupa W Układzie Okresowym Pierwiastków
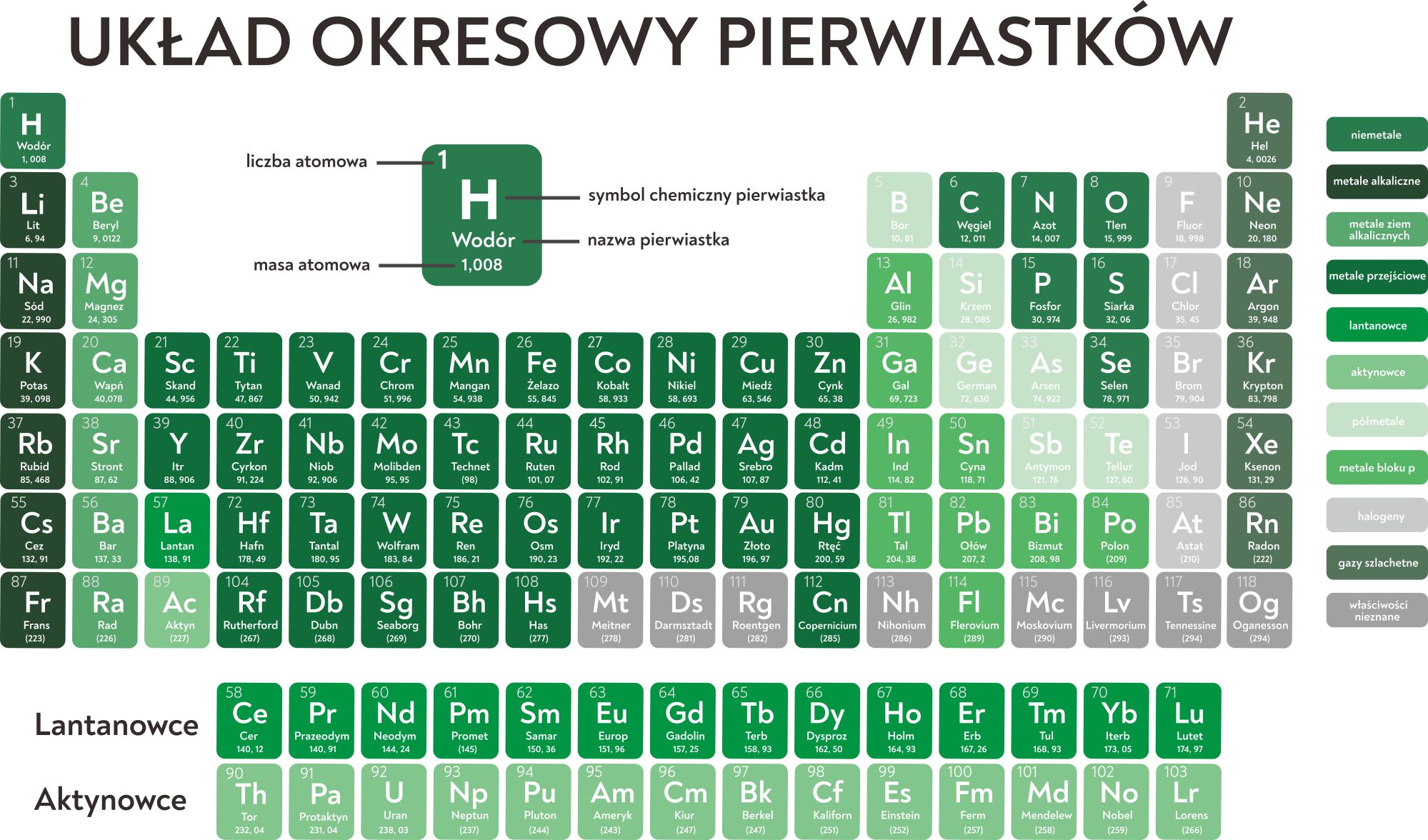
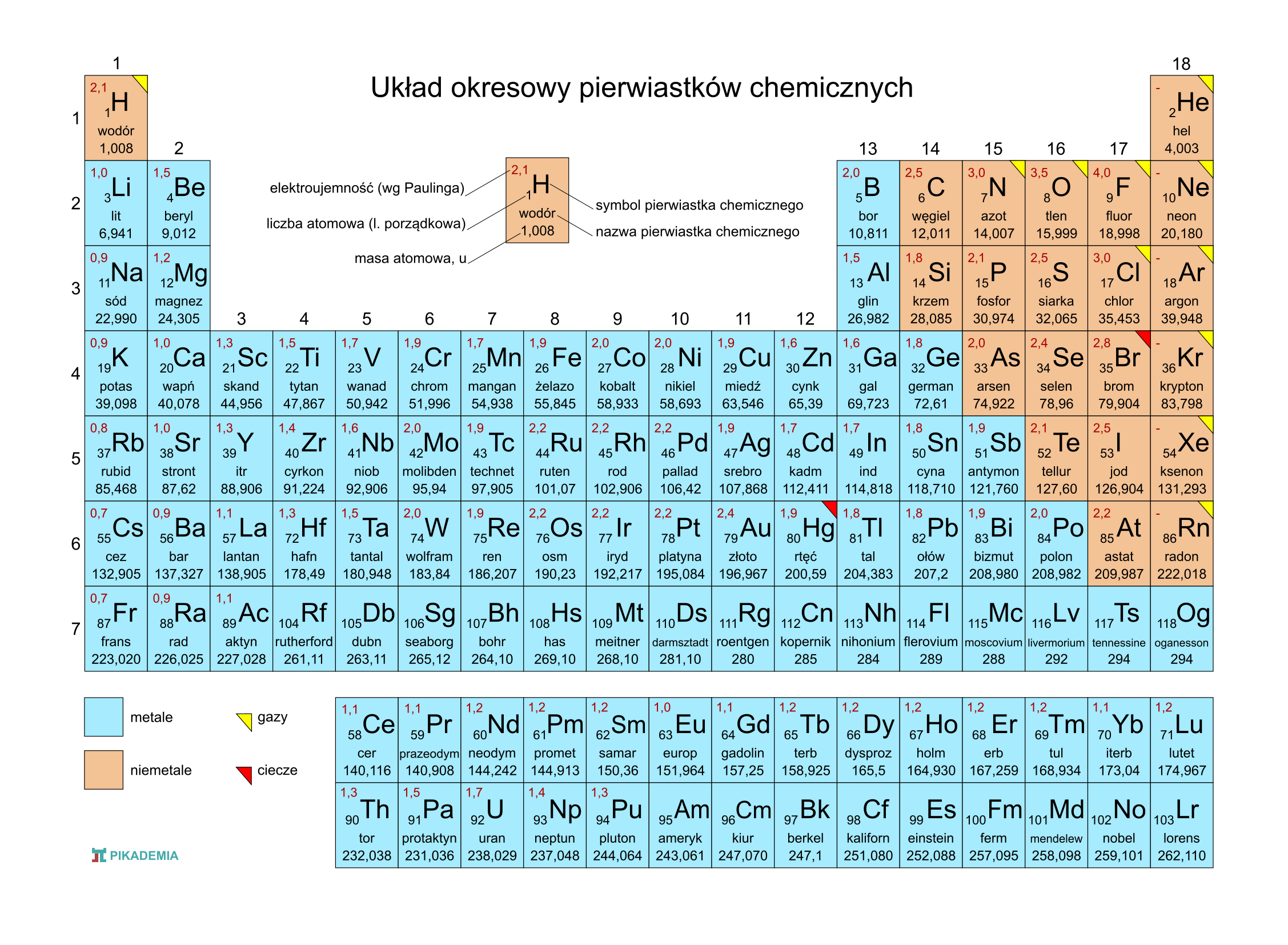
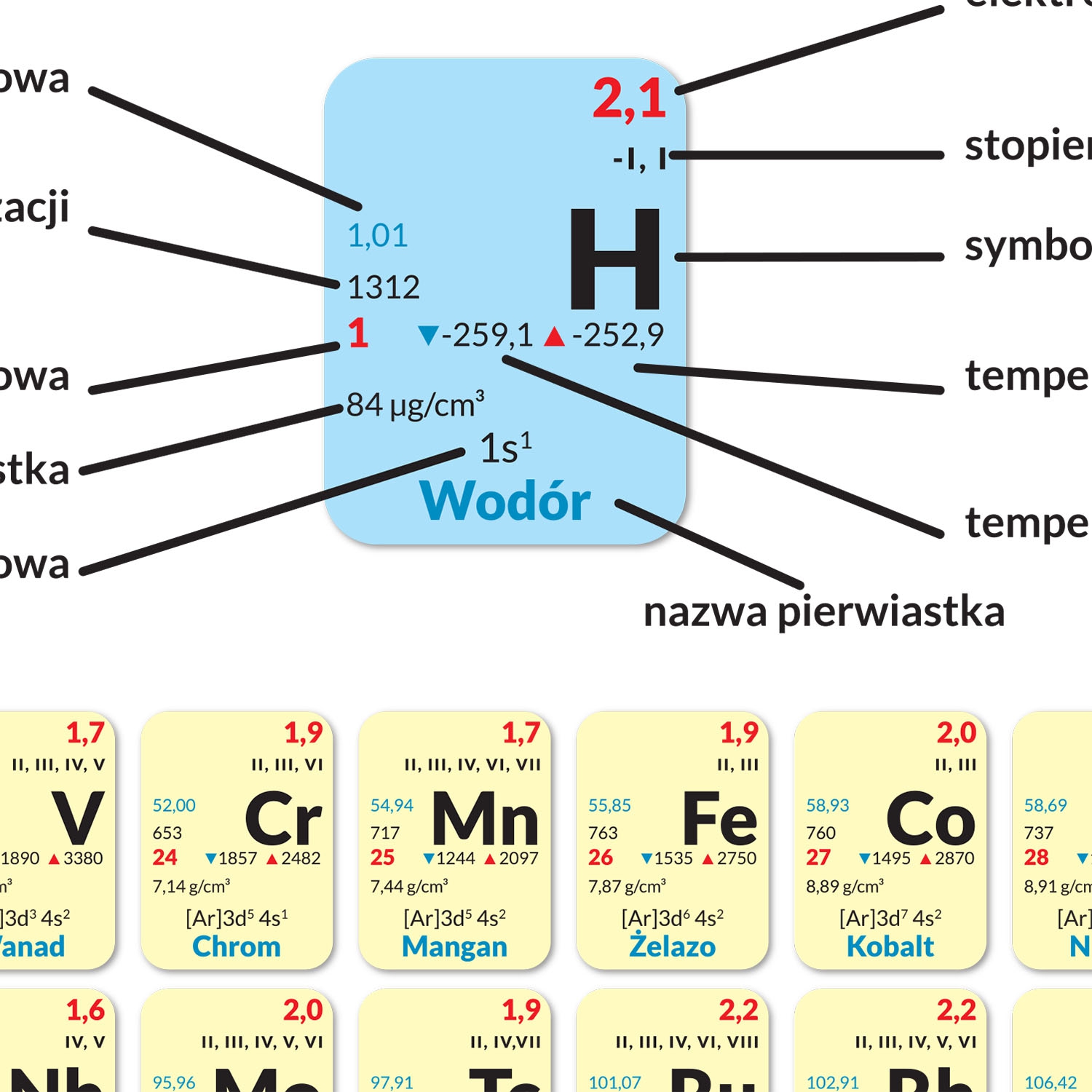
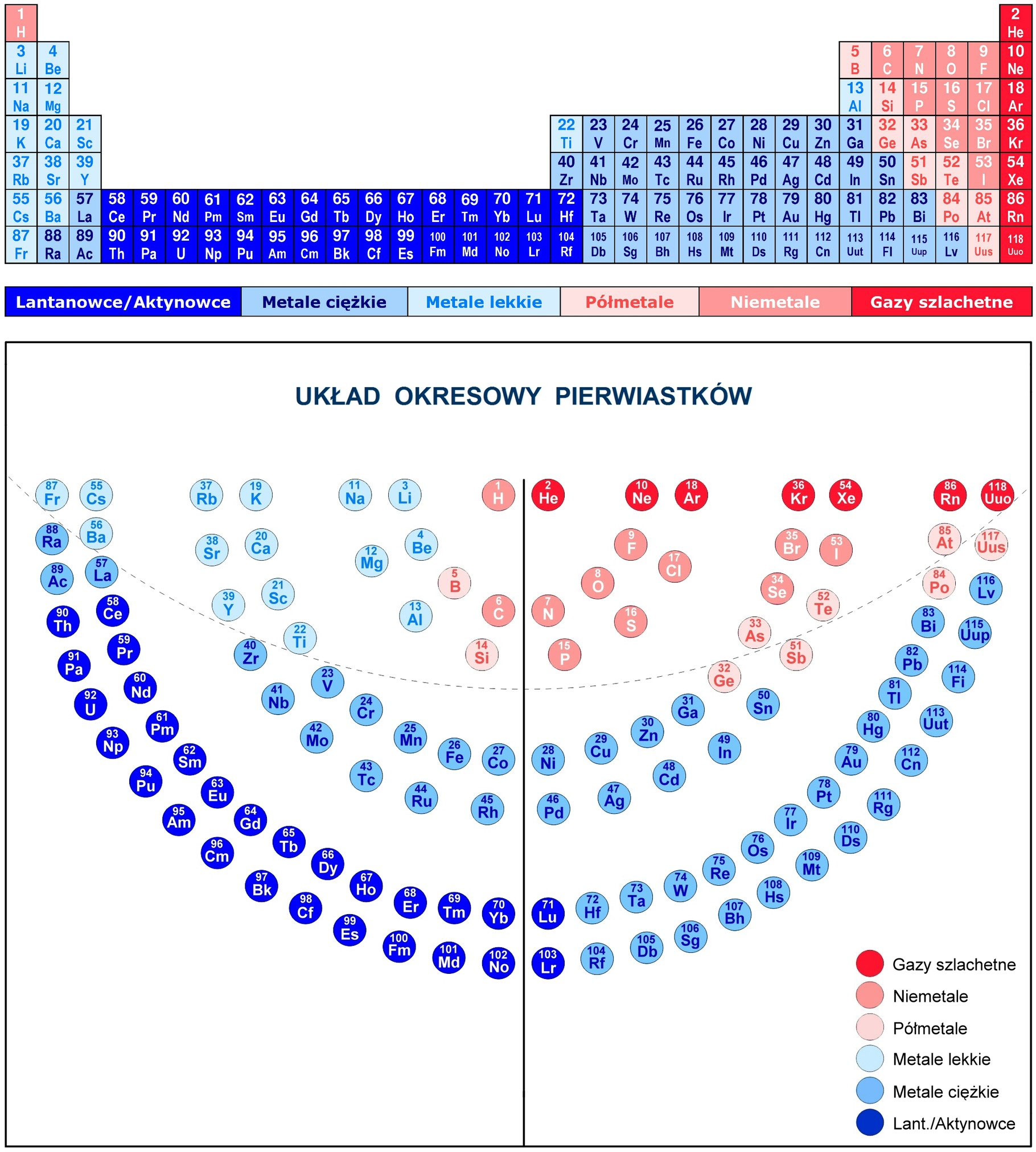
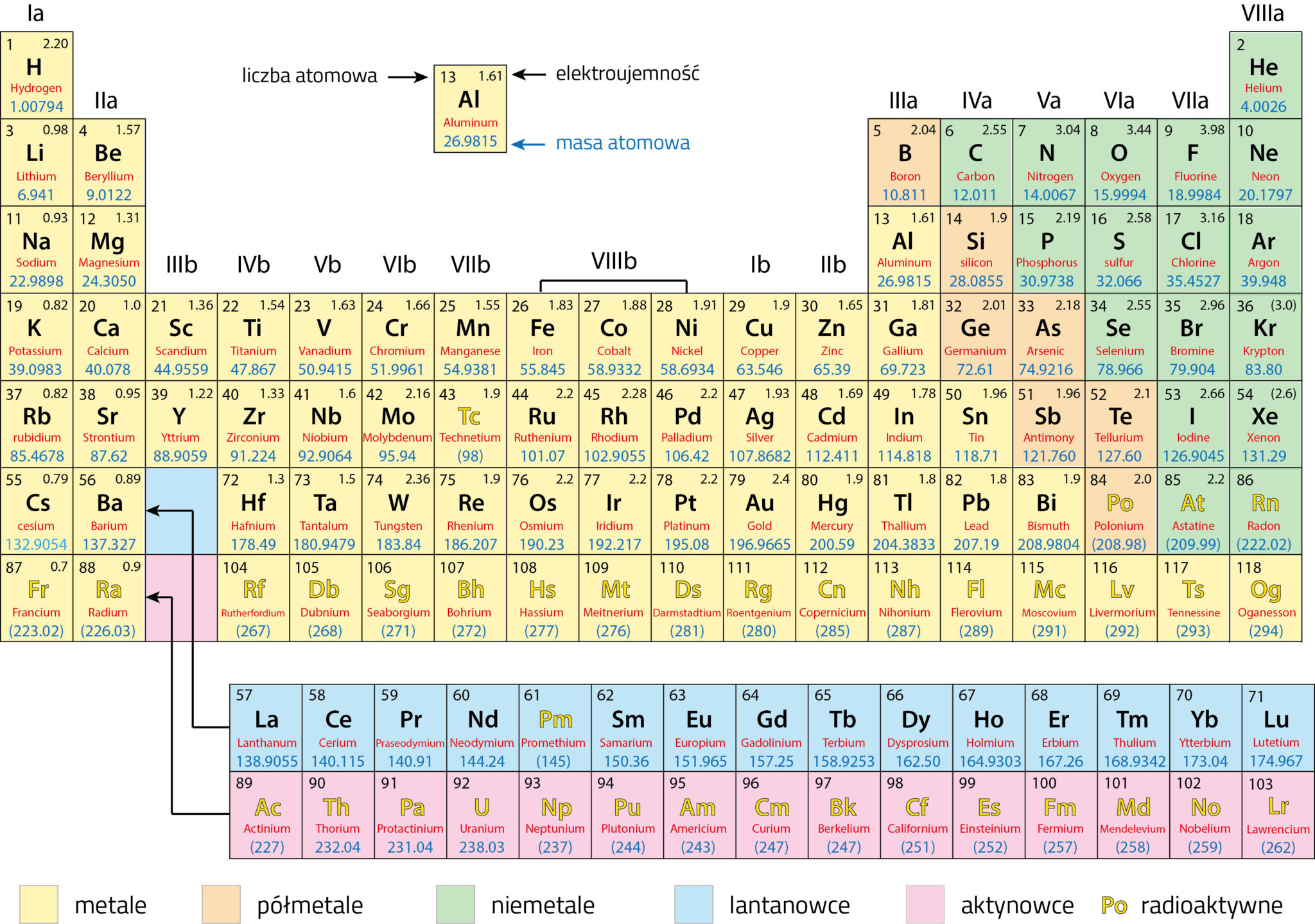
Układ okresowy pierwiastków, znany również jako tablica Mendelejewa, to fundamentalne narzędzie w chemii. Jego układ graficzny nie jest przypadkowy – odzwierciedla powtarzalność właściwości pierwiastków w zależności od ich budowy atomowej. Dwa kluczowe pojęcia związane z jego strukturą to okres i grupa. Zrozumienie ich lokalizacji i znaczenia jest niezbędne do efektywnego korzystania z tego narzędzia.
Okresy to poziome rzędy w układzie okresowym. Przejdźmy teraz do konkretnych przykładów, aby łatwiej zrozumieć to zagadnienie. Wodor, pierwszy pierwiastek, znajduje się w pierwszym okresie i w pierwszej grupie. Dalej, hel, umieszczony jest również w pierwszym okresie, ale już na końcu, w grupie 18. To krótki okres zawierający tylko dwa pierwiastki.
Drugi okres rozpoczyna się od litu (Li) w grupie 1 i biegnie przez beryl (Be) w grupie 2, bor (B) w grupie 13, węgiel (C) w grupie 14, azot (N) w grupie 15, tlen (O) w grupie 16, fluor (F) w grupie 17, aż do neonu (Ne) w grupie 18. Zauważmy, że właściwości litu i sodu, znajdującego się w następnym okresie, są podobne – oba są metalami alkalicznymi.
Trzeci okres zaczyna się od sodu (Na) w grupie 1 i kończy argonem (Ar) w grupie 18. Podobnie jak w drugim okresie, przechodzimy przez pierwiastki takie jak magnez (Mg), glin (Al), krzem (Si), fosfor (P), siarka (S) i chlor (Cl). Warto zwrócić uwagę, że pierwiastki w tym okresie wykazują stopniowe zmiany właściwości, od metalicznych do niemetalicznych.
Czwarty okres jest dłuższy i zawiera pierwiastki przejściowe, które znajdują się w środkowej części układu okresowego. Zaczyna się potasem (K) w grupie 1 i biegnie przez wapń (Ca) w grupie 2, a następnie przez skand (Sc) w grupie 3, tytan (Ti) w grupie 4, wanad (V) w grupie 5, chrom (Cr) w grupie 6, mangan (Mn) w grupie 7, żelazo (Fe) w grupie 8, kobalt (Co) w grupie 9, nikiel (Ni) w grupie 10, miedź (Cu) w grupie 11, cynk (Zn) w grupie 12, gal (Ga) w grupie 13, german (Ge) w grupie 14, arsen (As) w grupie 15, selen (Se) w grupie 16, brom (Br) w grupie 17, aż do kryptonu (Kr) w grupie 18. Obecność metali przejściowych w tym okresie wprowadza większą różnorodność właściwości chemicznych.
Piąty okres jest podobny do czwartego i również zawiera pierwiastki przejściowe. Rozpoczyna się rubidem (Rb) w grupie 1, strontem (Sr) w grupie 2 i kontynuuje przez itr (Y) w grupie 3, cyrkon (Zr) w grupie 4, niob (Nb) w grupie 5, molibden (Mo) w grupie 6, technet (Tc) w grupie 7, ruten (Ru) w grupie 8, rod (Rh) w grupie 9, pallad (Pd) w grupie 10, srebro (Ag) w grupie 11, kadm (Cd) w grupie 12, ind (In) w grupie 13, cyna (Sn) w grupie 14, antymon (Sb) w grupie 15, tellur (Te) w grupie 16, jod (I) w grupie 17, aż do ksenonu (Xe) w grupie 18.
Szósty okres jest jeszcze dłuższy, ponieważ zawiera lantanowce, które są wydzielone pod główną częścią układu okresowego. Zaczyna się cezjem (Cs) w grupie 1, barem (Ba) w grupie 2, a następnie przez lantan (La) w grupie 3. Po lantanie następuje 14 lantanowców (od ceru (Ce) do lutetu (Lu)), a następnie hafn (Hf) w grupie 4, tantal (Ta) w grupie 5, wolfram (W) w grupie 6, ren (Re) w grupie 7, osm (Os) w grupie 8, iryd (Ir) w grupie 9, platyna (Pt) w grupie 10, złoto (Au) w grupie 11, rtęć (Hg) w grupie 12, tal (Tl) w grupie 13, ołów (Pb) w grupie 14, bizmut (Bi) w grupie 15, polon (Po) w grupie 16, astat (At) w grupie 17, aż do radonu (Rn) w grupie 18.
Siódmy okres jest niekompletny i zawiera aktynowce, również wydzielone pod główną częścią układu okresowego. Rozpoczyna się fransem (Fr) w grupie 1, radem (Ra) w grupie 2, a następnie przez aktyn (Ac) w grupie 3. Po aktynie następuje szereg aktynowców (od toru (Th) do lorensa (Lr)), a następnie pierwiastki transuranowe. Wiele z tych pierwiastków jest syntetycznych i niestabilnych.
Grupy i ich znaczenie
Grupy, czyli kolumny pionowe w układzie okresowym, to rodziny pierwiastków wykazujących podobne właściwości chemiczne. To podobieństwo wynika z posiadania tej samej liczby elektronów walencyjnych, czyli elektronów znajdujących się na ostatniej powłoce elektronowej atomu. Elektrony walencyjne decydują o sposobie, w jaki pierwiastek łączy się z innymi, tworząc związki chemiczne.
Pierwsza grupa, nazywana grupą metali alkalicznych, obejmuje lit (Li), sód (Na), potas (K), rubid (Rb), cez (Cs) i frans (Fr). Są to bardzo reaktywne metale, które łatwo oddają jeden elektron, tworząc jony o ładunku +1. Reagują gwałtownie z wodą, tworząc wodorotlenki i wodór.
Druga grupa, grupa metali ziem alkalicznych, obejmuje beryl (Be), magnez (Mg), wapń (Ca), stront (Sr), bar (Ba) i rad (Ra). Są mniej reaktywne niż metale alkaliczne, ale również łatwo oddają dwa elektrony, tworząc jony o ładunku +2.
Grupa 17, czyli grupa fluorowców, obejmuje fluor (F), chlor (Cl), brom (Br), jod (I) i astat (At). Są to bardzo reaktywne niemetale, które łatwo przyjmują jeden elektron, tworząc jony o ładunku -1. Tworzą związki z wieloma innymi pierwiastkami, w tym z metalami, tworząc sole.
Grupa 18, czyli grupa gazów szlachetnych (helowców), obejmuje hel (He), neon (Ne), argon (Ar), krypton (Kr), ksenon (Xe) i radon (Rn). Są to pierwiastki bardzo mało reaktywne, ponieważ posiadają pełną powłokę elektronową. Historycznie nazywane były gazami obojętnymi, choć obecnie wiadomo, że niektóre z nich mogą tworzyć związki chemiczne, zwłaszcza z fluorem i tlenem.
Pierwiastki przejściowe, znajdujące się w grupach od 3 do 12, charakteryzują się różnorodnymi właściwościami chemicznymi i tworzą barwne związki. Często wykazują więcej niż jeden stopień utlenienia, co pozwala im na tworzenie złożonych związków koordynacyjnych.
Gdzie szukać informacji?
Układ okresowy jest dostępny w każdym podręczniku do chemii, w wielu wersjach online, a nawet na plakatach ściennych w laboratoriach. Istnieją interaktywne wersje, które pozwalają na uzyskanie szczegółowych informacji o każdym pierwiastku, w tym jego właściwościach fizycznych i chemicznych, zastosowaniach oraz historii odkrycia.
Korzystanie z układu okresowego wymaga pewnej praktyki, ale zrozumienie położenia okresów i grup oraz ich znaczenia, otwiera drzwi do zrozumienia wielu zjawisk chemicznych. Wiedza ta pozwala na przewidywanie właściwości pierwiastków i ich związków, a także na projektowanie nowych substancji o pożądanych właściwościach.
Zachęcam do dalszego zgłębiania wiedzy na temat układu okresowego i eksperymentowania z interaktywnymi wersjami, aby w pełni docenić jego wartość i znaczenie w chemii. Pamiętaj, że układ okresowy to nie tylko tablica liczb i symboli, ale mapa świata pierwiastków, która pomaga nam zrozumieć otaczającą nas rzeczywistość.
Podsumowanie
Podsumowując, okresy to poziome rzędy w układzie okresowym, a grupy to kolumny pionowe. Umiejscowienie pierwiastka w danym okresie informuje nas o liczbie powłok elektronowych w jego atomie, natomiast umiejscowienie w danej grupie wskazuje na podobieństwo właściwości chemicznych wynikające z liczby elektronów walencyjnych. Znajomość układu okresowego jest kluczowa dla każdego, kto interesuje się chemią i naukami pokrewnymi.