Gaz Szlachetny Którego Atom Ma 2 Powłoki Elektronowe
Czy kiedykolwiek zastanawiałeś się, co sprawia, że niektóre pierwiastki są tak niezwykłe, tak stabilne i tak niechętne do reagowania z innymi? W świecie chemii istnieje grupa pierwiastków, które wyróżniają się na tle pozostałych – gazy szlachetne. Charakteryzują się one pełną, zamkniętą powłoką elektronową, co nadaje im wyjątkową obojętność chemiczną. Ale skupmy się na jednym konkretnym przykładzie, gazie szlachetnym, którego atom posiada zaledwie dwie powłoki elektronowe.
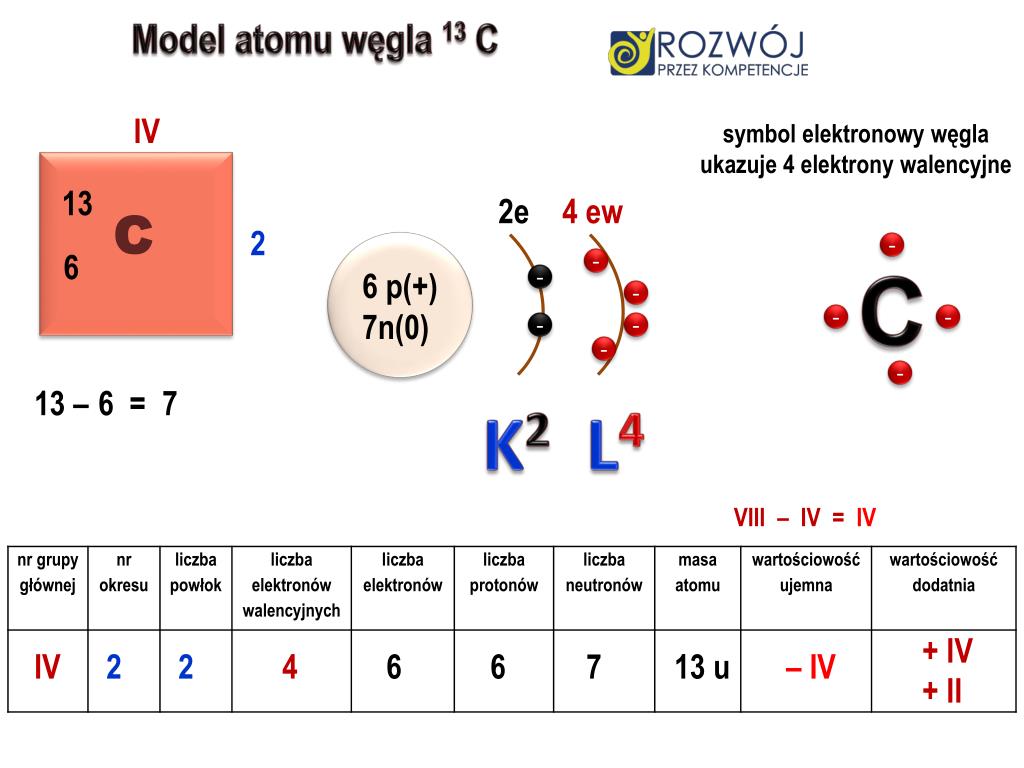
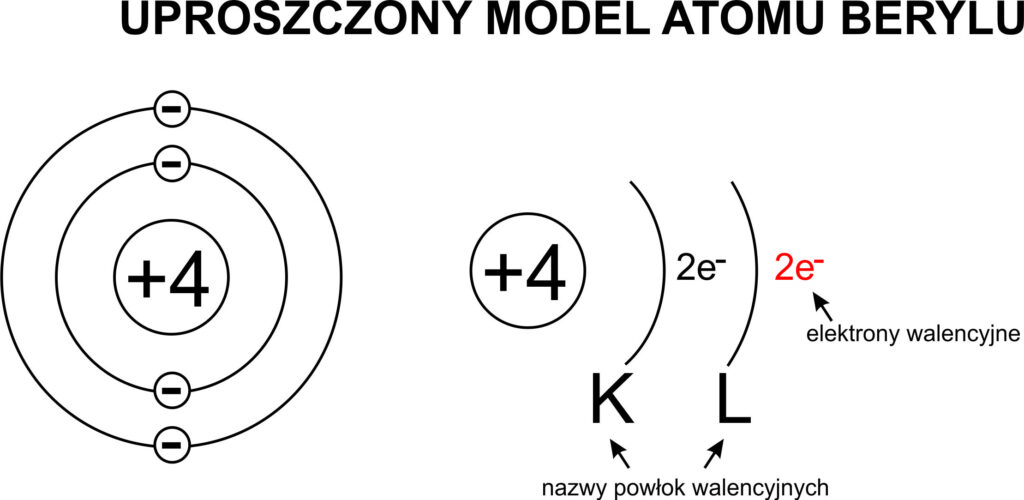
Przyjrzyjmy się strukturze atomu. Wiemy, że w centrum każdego atomu znajduje się jądro, zawierające protony i neutrony (z wyjątkiem protu, który ma tylko proton). Wokół jądra krążą elektrony, rozmieszczone na różnych poziomach energetycznych, zwanych powłokami elektronowymi. Te powłoki są numerowane, zaczynając od najbliższej jądru (n=1), a następnie n=2, n=3 i tak dalej. Każda powłoka ma określoną pojemność, czyli maksymalną liczbę elektronów, które może pomieścić. Pierwsza powłoka (n=1) może pomieścić maksymalnie 2 elektrony, druga (n=2) – 8 elektronów, trzecia (n=3) – 18 elektronów, i tak dalej.
Gaz szlachetny, który nas interesuje, posiada atom z zaledwie dwoma powłokami elektronowymi. Oznacza to, że jego atom ma jądro, pierwszą powłokę z 2 elektronami i drugą powłokę, która również jest pełna. Skoro druga powłoka jest pełna, musi zawierać 8 elektronów. W sumie ten atom ma 2 + 8 = 10 elektronów. A atom obojętny elektrycznie ma tyle samo protonów co elektronów. Zatem nasz gaz szlachetny ma również 10 protonów w swoim jądrze. Pierwiastek, którego atom ma 10 protonów, to neon (Ne).
Neon, oznaczony symbolem Ne, jest bezbarwnym, bezzapachowym i obojętnym chemicznie gazem. Jest on drugim najlżejszym gazem szlachetnym i zajmuje 10. miejsce w układzie okresowym. Jego konfiguracja elektronowa to 1s² 2s² 2p⁶. Możemy to interpretować tak: pierwsza powłoka (1s²) ma 2 elektrony, a druga powłoka (2s² 2p⁶) ma 2 elektrony w podpowłoce "s" i 6 elektronów w podpowłoce "p", co daje w sumie 8 elektronów na drugiej powłoce. Ta pełna druga powłoka sprawia, że neon jest niezwykle stabilny i niechętny do tworzenia wiązań chemicznych z innymi atomami.
Neon został odkryty w 1898 roku przez brytyjskich chemików Sir Williama Ramsaya i Morrisa W. Traversa. Odkryli go podczas badania skroplonego powietrza. Nazwa "neon" pochodzi od greckiego słowa "neos", oznaczającego "nowy". Ramsay i Travers znaleźli go jako niewielki składnik w powietrzu, stanowiący około 0,0018% atmosfery ziemskiej. Jest uzyskiwany na skalę przemysłową poprzez frakcjonowaną destylację skroplonego powietrza.
Właściwości i Zastosowania Neonu
Neon, będąc gazem szlachetnym, charakteryzuje się szeregiem unikalnych właściwości, które czynią go przydatnym w wielu zastosowaniach. Jedną z najbardziej znanych jest jego zdolność do emitowania jasnego, czerwono-pomarańczowego światła, gdy przepływa przez niego prąd elektryczny. To zjawisko jest wykorzystywane w neonowych reklamach i oświetleniu.
Oprócz charakterystycznej barwy, neon wykazuje również inne interesujące właściwości. Ma bardzo niską temperaturę wrzenia (-246°C) i krzepnięcia (-249°C). Jest również stosunkowo słabo rozpuszczalny w wodzie. Jego obojętność chemiczna sprawia, że jest bezpieczny w użyciu w wielu zastosowaniach, gdzie wymagana jest substancja niereaktywna.
Zastosowania neonu są różnorodne. Oprócz wspomnianych neonowych reklam, neon jest używany w:
- Lampach wyładowczych: Neon, w połączeniu z innymi gazami, jest wykorzystywany w lampach wyładowczych do generowania światła o różnych barwach.
- Wskaźnikach wysokiego napięcia: Ze względu na swoje właściwości elektryczne, neon jest stosowany w wskaźnikach do wykrywania obecności wysokiego napięcia.
- Chłodnictwie: Choć mniej powszechnie niż inne gazy, neon może być używany jako czynnik chłodniczy w niektórych zastosowaniach kriogenicznych.
- Mieszaninach oddechowych: W niektórych przypadkach, neon jest mieszany z tlenem i wykorzystywany jako mieszanina oddechowa, szczególnie w głębokim nurkowaniu. Pozwala to na zmniejszenie oporu oddechowego.
- Detektorach cząstek: Neon, ze względu na swoją obojętność, jest wykorzystywany jako wypełnienie w detektorach cząstek elementarnych.
Neon, chociaż jest gazem szlachetnym i wydaje się być "nieaktywny", ma istotny wpływ na nasze codzienne życie. Jego jasne światło rozświetla miasta, a jego unikalne właściwości znajdują zastosowanie w zaawansowanych technologiach.
Stabilność Elektronowa Neonu: Klucz do Obojętności
Dlaczego neon jest tak obojętny chemicznie? Odpowiedź tkwi w jego konfiguracji elektronowej. Jak już wspomniano, neon ma dwie powłoki elektronowe, z których obie są w pełni obsadzone. Pierwsza powłoka ma 2 elektrony, a druga ma 8 elektronów. Ta pełna druga powłoka, zwana również oktetem elektronowym, jest wyjątkowo stabilna.
Atomy dążą do osiągnięcia konfiguracji elektronowej gazu szlachetnego, ponieważ jest to stan najniższej energii i największej stabilności. Atomy innych pierwiastków mogą to osiągnąć poprzez oddawanie, przyjmowanie lub uwspólnianie elektronów z innymi atomami, co prowadzi do tworzenia wiązań chemicznych. Jednak neon już posiada pełną powłokę walencyjną, więc nie ma potrzeby tworzenia wiązań chemicznych z innymi atomami. Nie musi ani oddawać, ani przyjmować elektronów.
Oczywiście, w ekstremalnych warunkach, takich jak bardzo wysokie ciśnienie lub promieniowanie, neon może tworzyć związki chemiczne, ale są one bardzo nietrwałe i istnieją tylko w specyficznych warunkach laboratoryjnych. W normalnych warunkach neon pozostaje gazem obojętnym, nie reagującym z innymi substancjami.
Neon a Inne Gazy Szlachetne
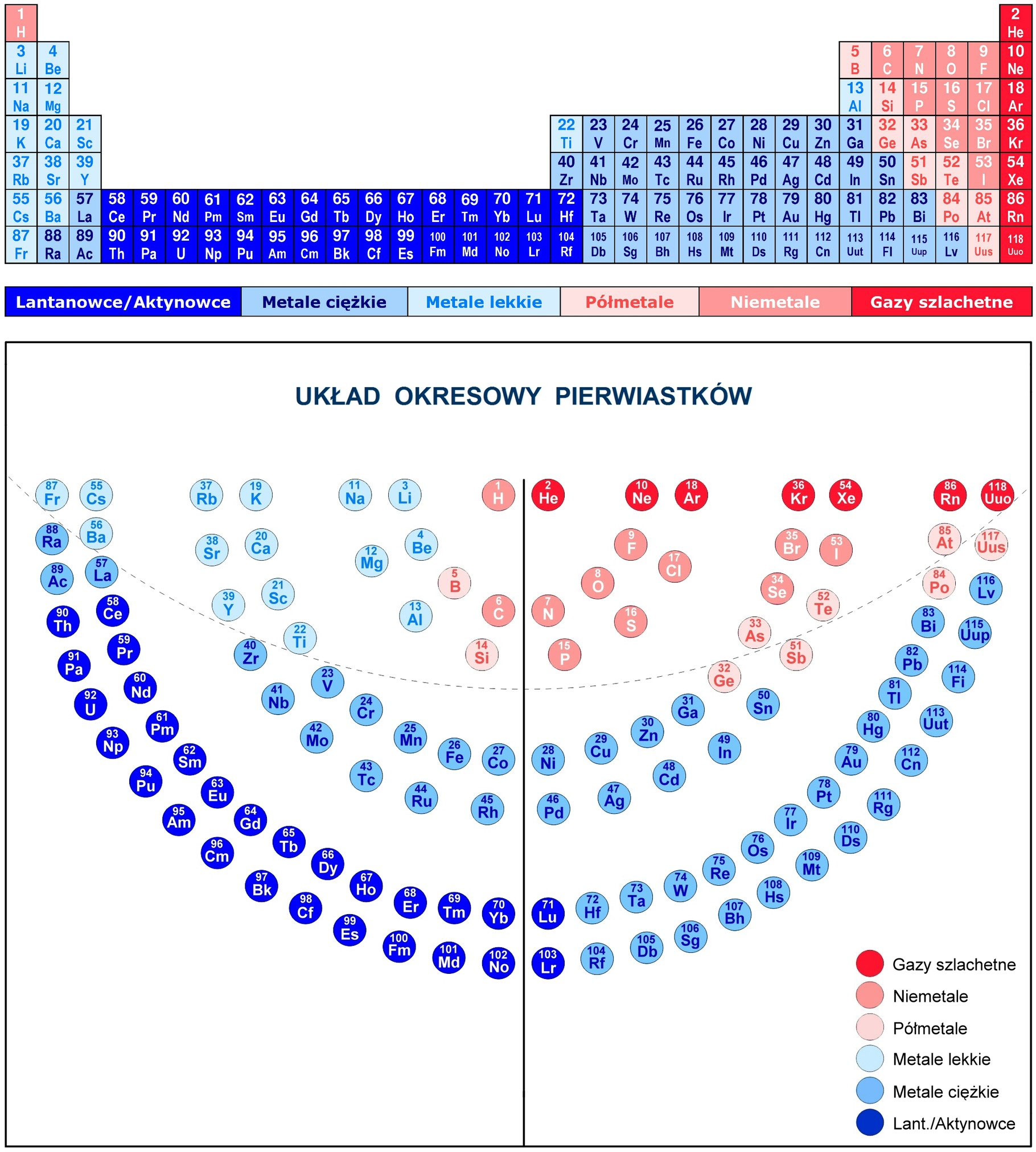
Warto na chwilę porównać neon z innymi gazami szlachetnymi, takimi jak hel, argon, krypton, ksenon i radon. Wszystkie one charakteryzują się pełną powłoką walencyjną, co nadaje im podobną obojętność chemiczną. Różnią się jednak liczbą powłok elektronowych i właściwościami fizycznymi.
Hel (He) ma tylko jedną powłokę elektronową, która może pomieścić maksymalnie 2 elektrony. Argon (Ar) ma trzy powłoki elektronowe, a trzecia powłoka jest pełna (8 elektronów). Krypton (Kr) ma cztery powłoki elektronowe, ksenon (Xe) ma pięć, a radon (Rn) ma sześć. Wraz ze wzrostem liczby powłok elektronowych rośnie rozmiar atomu i maleje energia jonizacji, czyli energia potrzebna do oderwania elektronu od atomu. To sprawia, że cięższe gazy szlachetne są nieco bardziej reaktywne niż lżejsze.
Mimo różnic, wszystkie gazy szlachetne łączy obojętność chemiczna, wynikająca z pełnej powłoki walencyjnej. To właśnie ta cecha sprawia, że są one tak wyjątkowe i przydatne w wielu zastosowaniach, od oświetlenia po zaawansowane technologie. A neon, z jego prostą strukturą atomową składającą się z dwóch powłok elektronowych, stanowi doskonały przykład gazu szlachetnego, którego stabilność elektronowa determinuje jego niezwykłe właściwości.