Elektrony Walencyjne Grupy 3 12

Zastanawiałeś się kiedyś, co tak naprawdę decyduje o tym, jak różne pierwiastki wchodzą ze sobą w reakcje chemiczne? Odpowiedź kryje się w elektronach walencyjnych, a zrozumienie ich roli otwiera drzwi do fascynującego świata chemii. W tym artykule skupimy się na elektronach walencyjnych pierwiastków z grupy 3 i 12 układu okresowego. Spróbujemy wytłumaczyć, jak te elektrony wpływają na ich właściwości i zachowanie.
Co to są elektrony walencyjne i dlaczego są tak ważne?
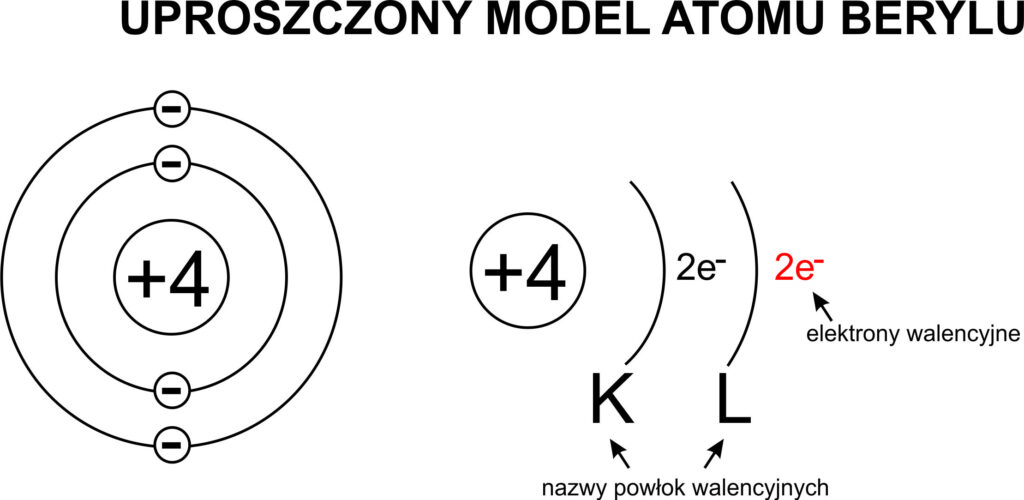
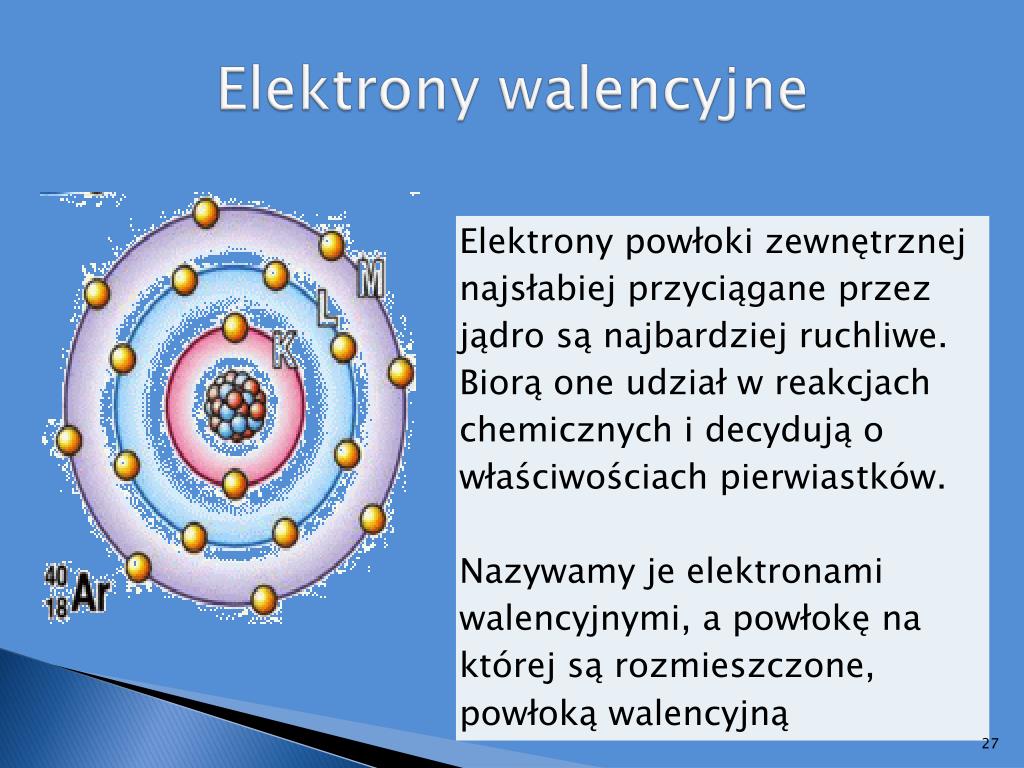
Elektrony walencyjne to elektrony znajdujące się na zewnętrznej powłoce elektronowej atomu. To one są odpowiedzialne za tworzenie wiązań chemicznych z innymi atomami. Decydują o tym, czy dany atom chętnie oddaje elektrony, czy raczej je przyjmuje, a także o tym, jakie rodzaje wiązań może tworzyć. Ilość elektronów walencyjnych determinuje właściwości chemiczne pierwiastka, a więc jego zdolność do reagowania z innymi substancjami.
Pomyśl o tym jak o języku, którym atomy się porozumiewają. Elektrony walencyjne to słowa i zwroty, za pomocą których atomy "dogadują się" i tworzą cząsteczki, budując wszystko, co nas otacza. Bez elektronów walencyjnych nie byłoby wiązań chemicznych, a więc nie byłoby związków chemicznych, a co za tym idzie – nie istniałoby życie w znanej nam formie.
Zrozumienie elektronów walencyjnych jest kluczowe dla zrozumienia chemii. Umożliwia przewidywanie, jakie reakcje zajdą między różnymi substancjami, a także projektowanie nowych materiałów o pożądanych właściwościach.
Elektrony walencyjne w grupie 3 układu okresowego
Grupa 3 układu okresowego to grupa pierwiastków, które charakteryzują się posiadaniem trzech elektronów walencyjnych. Do grupy tej zaliczamy skand (Sc), itr (Y), lantan (La) oraz aktyn (Ac). Również lantanowce i aktynowce są czasami włączane do tej grupy z uwagi na podobieństwa w konfiguracji elektronowej.
Te trzy elektrony walencyjne sprawiają, że pierwiastki te chętnie oddają elektrony, tworząc kationy o ładunku +3. Oznacza to, że są elektrododatnie i łatwo reagują z pierwiastkami elektroujemnymi, takimi jak tlen czy chlor, tworząc związki jonowe. Na przykład, skand tworzy tlenek skandu (Sc2O3), a itr tworzy tlenek itru (Y2O3).
Właściwości pierwiastków grupy 3:
- Wysoka reaktywność: Ze względu na łatwość oddawania elektronów.
- Tworzenie związków jonowych: Dominujący typ wiązań chemicznych.
- Wysokie temperatury topnienia i wrzenia: Charakterystyczne dla metali.
- Twardość i wytrzymałość: Właściwości mechaniczne typowe dla metali.
Przykładem praktycznego zastosowania pierwiastków grupy 3 jest wykorzystanie itru w produkcji luminoforów do ekranów telewizyjnych i monitorów. Luminofory to substancje, które emitują światło pod wpływem promieniowania, a itry są cenione za swoje specyficzne właściwości luminescencyjne.
Konfiguracja elektronowa grupy 3
Konfiguracja elektronowa pierwiastków grupy 3 (ogólnie [X]ns2(n-1)d1) tłumaczy ich zachowanie. Dwa elektrony na podpowłoce *s* i jeden na podpowłoce *d* powodują, że atom łatwo traci te trzy elektrony, aby osiągnąć stabilną konfigurację gazu szlachetnego w warstwie wewnętrznej. Wyjątek stanowią tu lantanowce i aktynowce, gdzie sytuacja jest bardziej złożona z uwagi na udział elektronów *f* w tworzeniu wiązań.
Elektrony walencyjne w grupie 12 układu okresowego
Grupa 12 układu okresowego obejmuje cynk (Zn), kadm (Cd) i rtęć (Hg). Tradycyjnie uważa się, że te pierwiastki posiadają dwa elektrony walencyjne, jednak ich chemia jest bardziej złożona niż w przypadku typowych metali alkalicznych ziem. Wynika to z faktu, że podpowłoka *d* jest w pełni zapełniona, co wpływa na ich zdolność do tworzenia wiązań.
W przeciwieństwie do pierwiastków grupy 3, pierwiastki grupy 12 niechętnie oddają elektrony. Tworzą związki, w których stopień utlenienia wynosi głównie +2, ale możliwe są również inne stopnie utlenienia w specyficznych warunkach. Cynk i kadm wykazują właściwości typowe dla metali przejściowych, choć technicznie nimi nie są (mają zapełnioną podpowłokę d). Rtęć, jako jedyny metal w stanie ciekłym w temperaturze pokojowej, charakteryzuje się wyjątkowymi właściwościami.
Właściwości pierwiastków grupy 12:
- Mniejsza reaktywność niż pierwiastki grupy 3: Trudniej oddają elektrony.
- Tworzenie związków kowalencyjnych i jonowych: Oba typy wiązań są możliwe.
- Różnorodne zastosowania: Od powłok ochronnych po elementy elektroniczne i stomatologię (amalgamat).
- Toksyczność: Szczególnie dotyczy kadmu i rtęci.
Cynk jest powszechnie stosowany do cynkowania stali, co chroni ją przed korozją. Kadm znajduje zastosowanie w akumulatorach niklowo-kadmowych. Rtęć, ze względu na swoje właściwości fizyczne i chemiczne, była kiedyś używana w termometrach i barometrach, ale ze względu na jej toksyczność, jej zastosowanie jest obecnie ograniczone.
Konfiguracja elektronowa grupy 12
Konfiguracja elektronowa pierwiastków grupy 12 (ogólnie [X]ns2(n-1)d10) wyjaśnia ich specyficzne zachowanie. Pełna podpowłoka *d* sprawia, że elektrony te są trudniej dostępne do tworzenia wiązań, co tłumaczy niższą reaktywność w porównaniu do pierwiastków z niepełną podpowłoką *d*. Niemniej jednak, elektrony *s* na powłoce walencyjnej są odpowiedzialne za tworzenie wiązań chemicznych.
Porównanie grupy 3 i 12 – kluczowe różnice
Chociaż obie grupy zawierają metale, różnice w ich konfiguracji elektronowej i liczbie elektronów walencyjnych prowadzą do znaczących różnic w ich właściwościach i zastosowaniach.
Grupa 3:
- 3 elektrony walencyjne: Wysoka reaktywność i tworzenie związków jonowych.
- Silne metale elektrododatnie: Łatwo oddają elektrony.
- Zastosowania: Luminofory, stopy o wysokiej wytrzymałości.
Grupa 12:
- 2 elektrony walencyjne (formalnie): Mniejsza reaktywność, tworzenie związków jonowych i kowalencyjnych.
- Metale o zróżnicowanych właściwościach: Od cynku do rtęci (ciekłej w temperaturze pokojowej).
- Zastosowania: Powłoki ochronne, akumulatory, stomatologia.
Podsumowując, liczba elektronów walencyjnych jest fundamentalnym czynnikiem determinującym właściwości chemiczne pierwiastków. Zrozumienie tej koncepcji pozwala przewidywać i wyjaśniać zachowanie różnych pierwiastków i ich związków, otwierając drzwi do lepszego zrozumienia otaczającego nas świata.
Podsumowanie
Mamy nadzieję, że ten artykuł pomógł Ci zrozumieć rolę elektronów walencyjnych w kontekście pierwiastków z grupy 3 i 12 układu okresowego. Zapamiętaj, że elektrony walencyjne to klucz do zrozumienia chemii i właściwości materiałów. Od ich liczby i konfiguracji zależy, czy dany pierwiastek chętnie reaguje z innymi, jakie wiązania tworzy i jakie ma właściwości.
Od ilości elektronów walencyjnych zależą właściwości i zastosowania pierwiastków, które codziennie spotykamy w otaczającym nas świecie. Rozumiejąc, jak funkcjonują elektrony walencyjne, możemy lepiej rozumieć budowę materii i procesy zachodzące w przyrodzie.