Dysocjacja Kwasu Węglowego

Czy kiedykolwiek zastanawiałeś się, dlaczego deszcz jest lekko kwaśny, albo jak nasz organizm reguluje pH krwi? Odpowiedź leży w procesie dysocjacji kwasu węglowego. Ten artykuł, skierowany do studentów chemii, biologii oraz wszystkich zainteresowanych naukami przyrodniczymi, ma na celu szczegółowe wyjaśnienie tego fundamentalnego zjawiska. Zrozumienie dysocjacji kwasu węglowego jest kluczowe dla zrozumienia wielu procesów chemicznych i biologicznych zachodzących wokół nas i wewnątrz nas.
Co to jest dysocjacja kwasu węglowego?
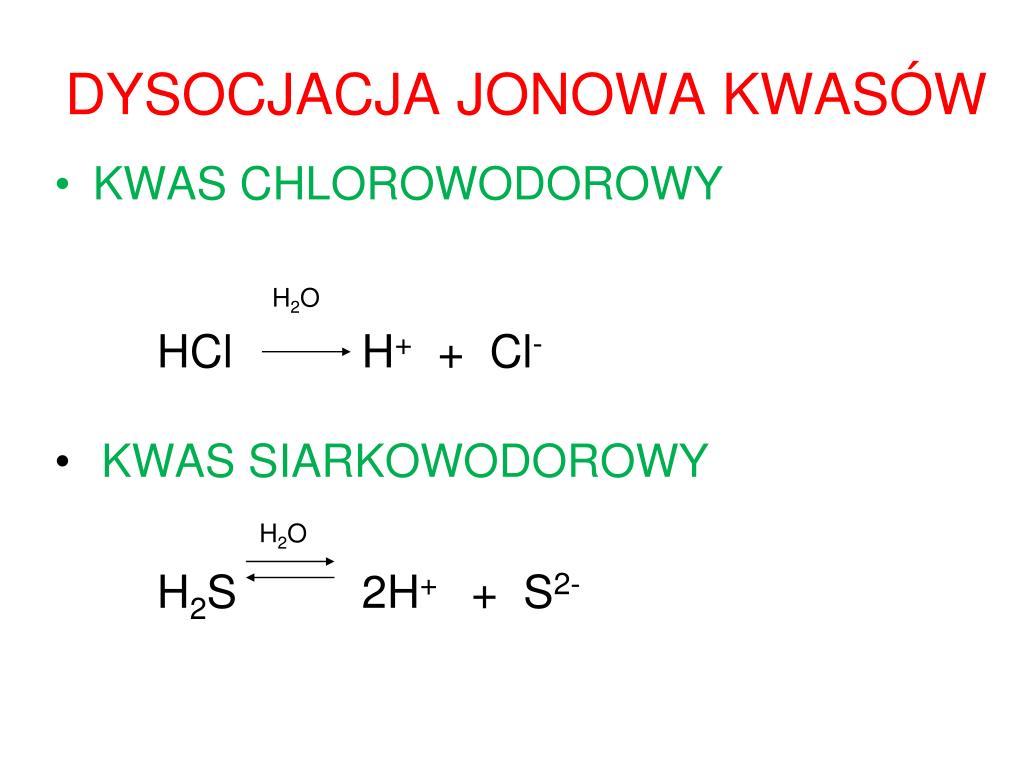
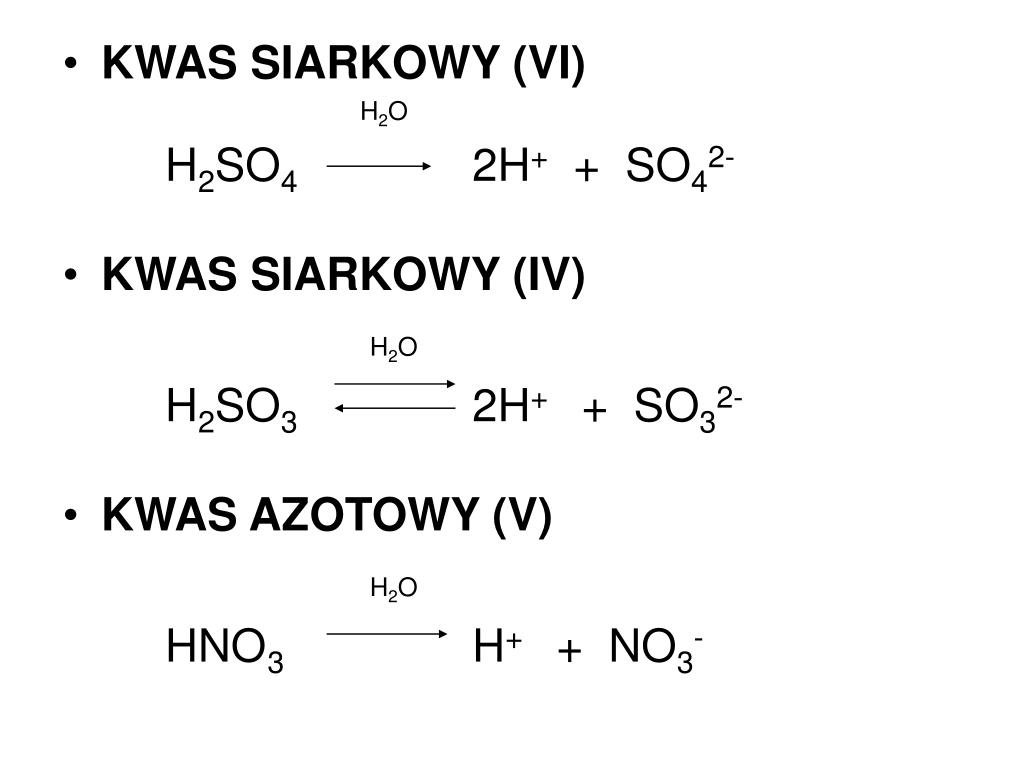
Kwas węglowy (H2CO3) to słaby kwas, który powstaje w wyniku rozpuszczenia dwutlenku węgla (CO2) w wodzie (H2O). Reakcja ta jest odwracalna i stanowi podstawę układu buforowego węglanowego, niezwykle istotnego dla utrzymania stałego pH w organizmach żywych oraz w środowisku naturalnym. Dysocjacja kwasu węglowego to proces, w którym kwas węglowy rozkłada się na jony w roztworze wodnym. Proces ten zachodzi dwuetapowo:
- Etap 1: Kwas węglowy oddaje jeden proton (H+), tworząc jon wodorowęglanowy (HCO3-).
H2CO3 ⇌ H+ + HCO3-
- Etap 2: Jon wodorowęglanowy oddaje kolejny proton, tworząc jon węglanowy (CO32-).
HCO3- ⇌ H+ + CO32-
Warto zauważyć, że obie reakcje są odwracalne i zachodzą w stanie równowagi. Położenie tej równowagi zależy od wielu czynników, przede wszystkim od pH roztworu i ciśnienia parcjalnego dwutlenku węgla (pCO2).
Czynniki wpływające na dysocjację kwasu węglowego
pH roztworu
pH roztworu ma kluczowy wpływ na stopień dysocjacji kwasu węglowego. W środowisku kwaśnym (niskie pH) równowaga reakcji jest przesunięta w lewo, co oznacza, że przeważa forma niezjonizowana, czyli kwas węglowy (H2CO3). Dzieje się tak dlatego, że wysokie stężenie jonów wodorowych (H+) "wypycha" reakcję w kierunku tworzenia H2CO3 zgodnie z zasadą Le Chateliera-Brauna.
Z kolei w środowisku zasadowym (wysokie pH) równowaga jest przesunięta w prawo, co sprzyja tworzeniu jonów wodorowęglanowych (HCO3-) i węglanowych (CO32-). Wysokie pH "pochłania" jony wodorowe, przesuwając równowagę w kierunku dysocjacji, by je uzupełnić.
Ciśnienie parcjalne dwutlenku węgla (pCO2)
Ciśnienie parcjalne dwutlenku węgla (pCO2) wpływa na stężenie kwasu węglowego w roztworze. Im wyższe pCO2, tym więcej dwutlenku węgla rozpuszcza się w wodzie, tworząc więcej kwasu węglowego. Zwiększenie stężenia H2CO3 z kolei wpływa na przesunięcie równowagi dysocjacji, prowadząc do wzrostu stężenia jonów wodorowęglanowych i węglanowych.
Matematycznie zależność tę możemy przedstawić przy pomocy prawa Henry'ego, które mówi, że rozpuszczalność gazu w cieczy jest proporcjonalna do ciśnienia parcjalnego tego gazu nad cieczą.
Temperatura
Temperatura wpływa na rozpuszczalność dwutlenku węgla w wodzie. Im wyższa temperatura, tym niższa rozpuszczalność CO2, a co za tym idzie, niższe stężenie kwasu węglowego. To z kolei wpływa na przesunięcie równowagi dysocjacji. W niższych temperaturach obserwuje się większą rozpuszczalność CO2 i przesunięcie równowagi w stronę większego stężenia kwasu węglowego.
Znaczenie dysocjacji kwasu węglowego
Dysocjacja kwasu węglowego odgrywa kluczową rolę w wielu procesach, zarówno w organizmach żywych, jak i w środowisku naturalnym:
- Regulacja pH krwi: Układ buforowy węglanowy, oparty na dysocjacji kwasu węglowego, jest najważniejszym układem buforowym w ludzkiej krwi. Pomaga on utrzymać pH krwi w wąskim zakresie (7,35-7,45), co jest niezbędne do prawidłowego funkcjonowania enzymów i innych procesów metabolicznych. Zaburzenia równowagi kwasowo-zasadowej (np. kwasica lub zasadowica) mogą mieć poważne konsekwencje dla zdrowia.
- Transport dwutlenku węgla: Większość dwutlenku węgla produkowanego w tkankach jest transportowana do płuc w postaci jonów wodorowęglanowych. Proces ten zachodzi dzięki enzymowi anhydrazie węglanowej, który katalizuje reakcję tworzenia kwasu węglowego z dwutlenku węgla i wody w erytrocytach. Następnie, kwas węglowy dysocjuje, tworząc jony wodorowęglanowe, które są transportowane do płuc, gdzie reakcja przebiega w odwrotnym kierunku, umożliwiając wydalenie CO2.
- Procesy atmosferyczne: Dysocjacja kwasu węglowego w wodach oceanów i jezior wpływa na pH tych wód i ma istotny wpływ na cykl węglowy w przyrodzie. Dwutlenek węgla z atmosfery rozpuszcza się w wodzie, tworząc kwas węglowy, który następnie dysocjuje. Zwiększone stężenie CO2 w atmosferze, spowodowane działalnością człowieka, prowadzi do zakwaszenia oceanów, co ma negatywny wpływ na organizmy morskie, zwłaszcza te, które budują swoje szkielety i muszle z węglanu wapnia (CaCO3), np. koralowce.
- Formowanie jaskiń krasowych: Woda opadowa, nasycona dwutlenkiem węgla z atmosfery i gleby, tworzy słaby kwas węglowy. Kwas ten reaguje z węglanem wapnia (CaCO3), który jest głównym składnikiem skał wapiennych, rozpuszczając go. Proces ten, zachodzący przez tysiące lat, prowadzi do powstawania jaskiń krasowych i innych formacji krasowych.
Przykłady z życia wzięte
Zastanów się nad następującymi sytuacjami:
- Ćwiczenia fizyczne: Podczas intensywnego wysiłku fizycznego nasze mięśnie produkują więcej dwutlenku węgla. To prowadzi do obniżenia pH krwi (kwasica). Układ buforowy węglanowy neutralizuje nadmiar kwasu, chroniąc organizm przed negatywnymi skutkami.
- Napój gazowany: Bąbelki w napojach gazowanych to dwutlenek węgla. Kiedy otwierasz butelkę, zmniejszasz ciśnienie, co powoduje, że CO2 uwalnia się z roztworu, a napój "traci gaz".
- Zakwaszenie oceanów: Emisja dwutlenku węgla do atmosfery z działalności człowieka prowadzi do rozpuszczania się CO2 w oceanach, co powoduje zakwaszenie wody. To zagraża organizmom morskim, takim jak koralowce, które potrzebują węglanu wapnia do budowy swoich szkieletów.
Podsumowanie
Dysocjacja kwasu węglowego to fundamentalny proces chemiczny o ogromnym znaczeniu dla biologii i nauk o środowisku. Zrozumienie czynników wpływających na ten proces pozwala nam lepiej zrozumieć regulację pH w organizmach żywych, transport dwutlenku węgla, procesy atmosferyczne oraz wiele innych zjawisk zachodzących w przyrodzie.
Mamy nadzieję, że ten artykuł pomógł Ci zrozumieć, jak ważna jest dysocjacja kwasu węglowego. Zachęcamy do dalszego zgłębiania wiedzy na ten temat! Pamiętaj, że zrozumienie tych procesów jest kluczowe do podejmowania świadomych decyzji dotyczących naszego zdrowia i środowiska.
Dalsze studia i badania w tej dziedzinie pomogą nam lepiej zrozumieć i przeciwdziałać negatywnym skutkom zmian klimatycznych i innych problemów środowiskowych.