Dysocjacja Kwasu Octowego

Czy kiedykolwiek zastanawiałeś się, dlaczego ocet ma tak charakterystyczny kwaśny smak? A może interesuje Cię, jak powstają sole octanowe, wykorzystywane w wielu produktach? Odpowiedzi na te pytania kryją się w zjawisku dysocjacji kwasu octowego. Ten artykuł ma na celu wyjaśnienie tego procesu w sposób zrozumiały i przystępny, nawet jeśli Twoja wiedza z chemii jest podstawowa. Skierowany jest do uczniów szkół średnich, studentów początkujących kierunków chemicznych, entuzjastów domowych eksperymentów, a także do wszystkich osób ciekawych świata nauki.
Czym jest dysocjacja?
Zacznijmy od podstaw. Dysocjacja to proces, w którym związek chemiczny rozpada się na jony w roztworze. Dzieje się tak, gdy związek o charakterze jonowym lub polarnym (jak właśnie kwas octowy) zostaje rozpuszczony w rozpuszczalniku polarnym, takim jak woda. Siły oddziaływań między cząsteczkami rozpuszczalnika a cząsteczkami związku są na tyle silne, że pokonują siły wiążące cząsteczki związku, prowadząc do jego rozpadu na jony.
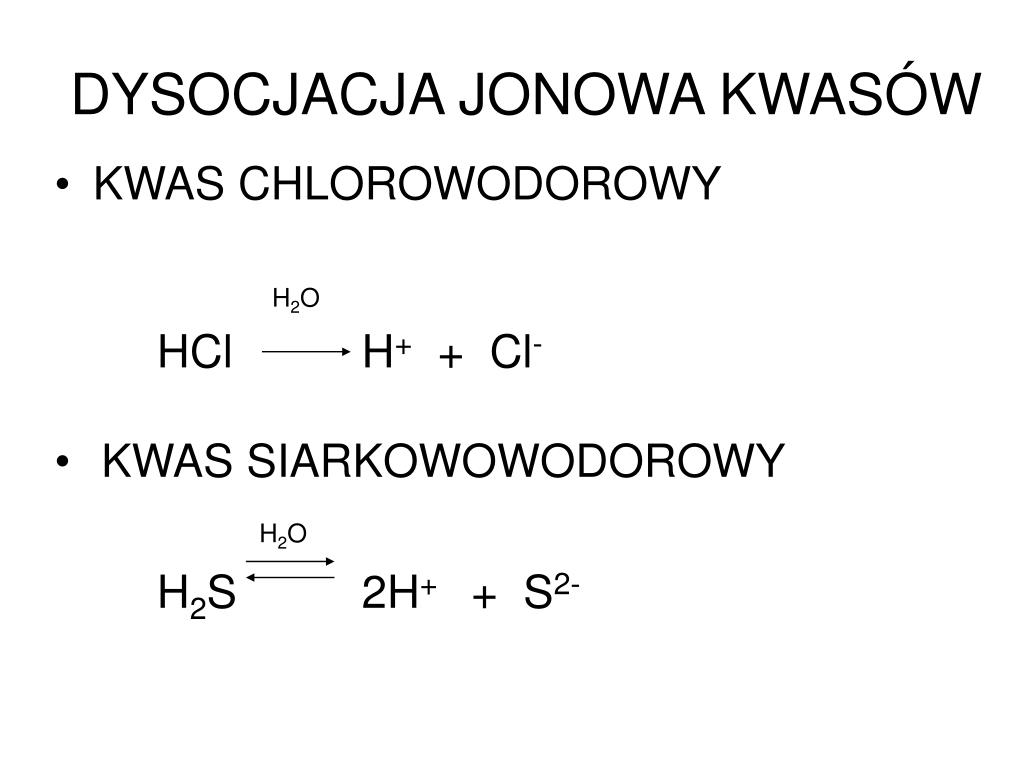
W przypadku kwasów, dysocjacja polega na odrywaniu się jonu wodorowego (H+) od cząsteczki kwasu i przechodzeniu go do roztworu. To obecność jonów wodorowych odpowiada za kwaśny charakter roztworu.
Kwas octowy: Charakterystyka
Kwas octowy (CH3COOH), znany również jako kwas etanowy, to organiczny związek chemiczny z grupy kwasów karboksylowych. Jest to bezbarwna ciecz o charakterystycznym, ostrym zapachu i kwaśnym smaku. W czystej postaci (bezwodny kwas octowy) nazywany jest lodowatym kwasem octowym. Jest głównym składnikiem octu, w którym występuje w stężeniu od 3% do 9%.
Właściwości kwasu octowego:
- Wzór sumaryczny: CH3COOH
- Masa molowa: 60.05 g/mol
- Temperatura topnienia: 16.7 °C
- Temperatura wrzenia: 118.1 °C
- Słaby kwas: Nie dysocjuje całkowicie w roztworze wodnym.
Dysocjacja kwasu octowego – krok po kroku
Kwas octowy jest słabym kwasem, co oznacza, że w roztworze wodnym dysocjuje tylko częściowo. Oznacza to, że jedynie część cząsteczek kwasu octowego rozpada się na jony. Równanie dysocjacji kwasu octowego przedstawia się następująco:
CH3COOH (aq) ⇌ CH3COO- (aq) + H+ (aq)
Co to oznacza w praktyce?
- CH3COOH (aq): To cząsteczka kwasu octowego rozpuszczona w wodzie (aq - aqueous).
- ⇌: To symbol równowagi. Oznacza, że reakcja zachodzi w obie strony: kwas octowy dysocjuje na jony, ale jony octanowe i wodorowe mogą również łączyć się z powrotem, tworząc kwas octowy.
- CH3COO- (aq): To jon octanowy (etanonianowy) rozpuszczony w wodzie. Jest to anion powstały po odłączeniu jonu wodorowego od kwasu octowego.
- H+ (aq): To jon wodorowy (proton) rozpuszczony w wodzie. To obecność tych jonów w roztworze powoduje, że roztwór ma odczyn kwaśny.
W rzeczywistości, jon wodorowy (H+) w roztworze wodnym występuje w postaci jonu oksoniowego (H3O+). Powstaje on w wyniku przyłączenia jonu H+ do cząsteczki wody. Dlatego równanie dysocjacji kwasu octowego można również zapisać w następujący sposób:
CH3COOH (aq) + H2O (l) ⇌ CH3COO- (aq) + H3O+ (aq)
Równanie to pokazuje, że kwas octowy oddaje proton cząsteczce wody, tworząc jon octanowy i jon oksoniowy.
Stała dysocjacji (Ka)
Stała dysocjacji kwasowej (Ka) to wartość, która określa, jak mocny jest dany kwas. Im wyższa wartość Ka, tym silniejszy kwas, czyli tym większa część cząsteczek kwasu ulega dysocjacji w roztworze. Dla kwasu octowego wartość Ka wynosi około 1.8 x 10-5 (przy 25°C). Jest to stosunkowo mała wartość, co potwierdza, że kwas octowy jest słabym kwasem.
Wartość Ka można obliczyć z następującego wzoru:
Ka = [CH3COO-] * [H+] / [CH3COOH]
Gdzie:
- [CH3COO-] to stężenie jonów octanowych w stanie równowagi.
- [H+] to stężenie jonów wodorowych w stanie równowagi.
- [CH3COOH] to stężenie niezdysocjowanego kwasu octowego w stanie równowagi.
pKa to ujemny logarytm dziesiętny ze stałej dysocjacji (Ka): pKa = -log(Ka). Dla kwasu octowego pKa wynosi około 4.76. Im niższa wartość pKa, tym silniejszy kwas.
Czynniki wpływające na dysocjację kwasu octowego
Na stopień dysocjacji kwasu octowego wpływa kilka czynników:
- Temperatura: Zazwyczaj, wraz ze wzrostem temperatury, stopień dysocjacji kwasu octowego nieco wzrasta. Dzieje się tak, ponieważ wyższa temperatura dostarcza energii potrzebnej do zerwania wiązań.
- Stężenie: Im większe stężenie kwasu octowego w roztworze, tym mniejszy stopień dysocjacji. Wynika to z przesunięcia równowagi w kierunku tworzenia się niezdysocjowanego kwasu octowego. Jest to zgodne z zasadą Le Chateliera-Brauna.
- Obecność innych jonów: Obecność jonów octanowych w roztworze (np. dodanie octanu sodu) spowoduje przesunięcie równowagi dysocjacji kwasu octowego w lewo, czyli zmniejszenie stopnia dysocjacji. Jest to tzw. efekt wspólnego jonu.
Dlaczego dysocjacja kwasu octowego jest ważna?
Zrozumienie dysocjacji kwasu octowego jest kluczowe z wielu powodów:
- Wyjaśnienie właściwości octu: To dysocjacja kwasu octowego odpowiada za kwaśny smak i właściwości konserwujące octu. Jon wodorowy (H+) jest odpowiedzialny za wrażenie kwaśności, a także hamuje rozwój wielu bakterii i pleśni.
- Zastosowania w chemii analitycznej: Znajomość stałej dysocjacji (Ka) kwasu octowego jest niezbędna w analizie chemicznej, na przykład przy obliczaniu pH roztworów buforowych.
- Produkcja soli octanowych: Reakcja kwasu octowego z zasadami prowadzi do powstania soli octanowych, takich jak octan sodu (CH3COONa) czy octan potasu (CH3COOK). Sole te znajdują szerokie zastosowanie w przemyśle spożywczym, farmaceutycznym i tekstylnym.
- Procesy biologiczne: Kwas octowy i jego sole odgrywają ważną rolę w wielu procesach biologicznych, na przykład w metabolizmie węglowodanów i tłuszczów.
Przykłady zastosowań wiedzy o dysocjacji kwasu octowego
Wyobraź sobie, że przygotowujesz roztwór buforowy. Roztwory buforowe są odporne na zmiany pH, nawet po dodaniu niewielkich ilości kwasu lub zasady. Roztwór kwasu octowego i octanu sodu jest przykładem takiego buforu. Znając wartość Ka kwasu octowego, możesz dokładnie obliczyć proporcje kwasu i soli potrzebne do uzyskania pożądanego pH buforu.
Inny przykład: podczas miareczkowania (czyli oznaczania stężenia kwasu octowego za pomocą zasady) ważne jest, aby znać jego charakterystyczne właściwości, w tym fakt, że jest to słaby kwas. Dzięki temu możesz prawidłowo dobrać wskaźnik i obliczyć punkt końcowy miareczkowania.
Podsumowanie
Dysocjacja kwasu octowego to proces rozpadu cząsteczek kwasu octowego na jony octanowe i wodorowe w roztworze wodnym. Jest to reakcja równowagowa, a stopień dysocjacji zależy od wielu czynników, takich jak temperatura, stężenie i obecność innych jonów. Kwas octowy jest słabym kwasem, co oznacza, że dysocjuje tylko częściowo. Zrozumienie tego procesu jest kluczowe dla zrozumienia właściwości octu, zastosowań kwasu octowego w chemii i przemyśle, a także jego roli w procesach biologicznych.
Mamy nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć zjawisko dysocjacji kwasu octowego. Teraz, gdy następnym razem sięgniesz po ocet, będziesz wiedział, co kryje się za jego kwaśnym smakiem! Pamiętaj, że chemia jest wszędzie wokół nas, a zrozumienie podstawowych zasad może otworzyć Ci drzwi do fascynującego świata nauki.