Dysocjacja Kwasu Mrówkowego

Rozumiem. Chemia, zwłaszcza ta organiczna, bywa onieśmielająca. Ilość reakcji, mechanizmów i wyjątków może przyprawić o zawrót głowy. Szczególnie, gdy mówimy o tak podstawowych, a zarazem fundamentalnych procesach, jak dysocjacja kwasów. Skupmy się dzisiaj na jednym z nich – dysocjacji kwasu mrówkowego. Pokażę Ci, że to wcale nie musi być takie straszne, a wręcz jest niezwykle ciekawe i ma realny wpływ na nasze życie. Przejdziemy przez to razem, krok po kroku.
Dlaczego Dysocjacja Kwasu Mrówkowego Jest Ważna?
Zanim zagłębimy się w szczegóły, warto zrozumieć, dlaczego w ogóle powinniśmy się tym zajmować. Dysocjacja kwasu mrówkowego, mimo swojej pozornej prostoty, odgrywa kluczową rolę w wielu dziedzinach:
- Przemysł spożywczy: Kwas mrówkowy jest naturalnym konserwantem. Zrozumienie jego dysocjacji pozwala optymalizować jego działanie, np. w kiszonkach czy paszach dla zwierząt.
- Rolnictwo: Jest stosowany jako środek zakwaszający glebę i dezynfekujący ule. Kontrola pH jest kluczowa dla zdrowego wzrostu roślin i rozwoju pszczół.
- Przemysł tekstylny: Wykorzystywany w procesach barwienia i wykańczania tkanin. Stabilne pH kąpieli barwiącej zapewnia równomierne i trwałe kolory.
- Laboratoria chemiczne: Kwas mrówkowy jest reagentem w wielu syntezach organicznych. Poznanie jego właściwości, w tym zdolności do dysocjacji, jest niezbędne do prawidłowego przebiegu reakcji.
- Środowisko: Kwas mrówkowy występuje naturalnie w przyrodzie, np. w jadzie mrówek. Jego obecność i wpływ na pH gleby i wód mają znaczenie ekologiczne.
Widzisz? To nie tylko teoretyczne rozważania. Dysocjacja kwasu mrówkowego ma realne przełożenie na to, co jemy, w co się ubieramy i w jakim środowisku żyjemy.
Czym Jest Dysocjacja Kwasu?
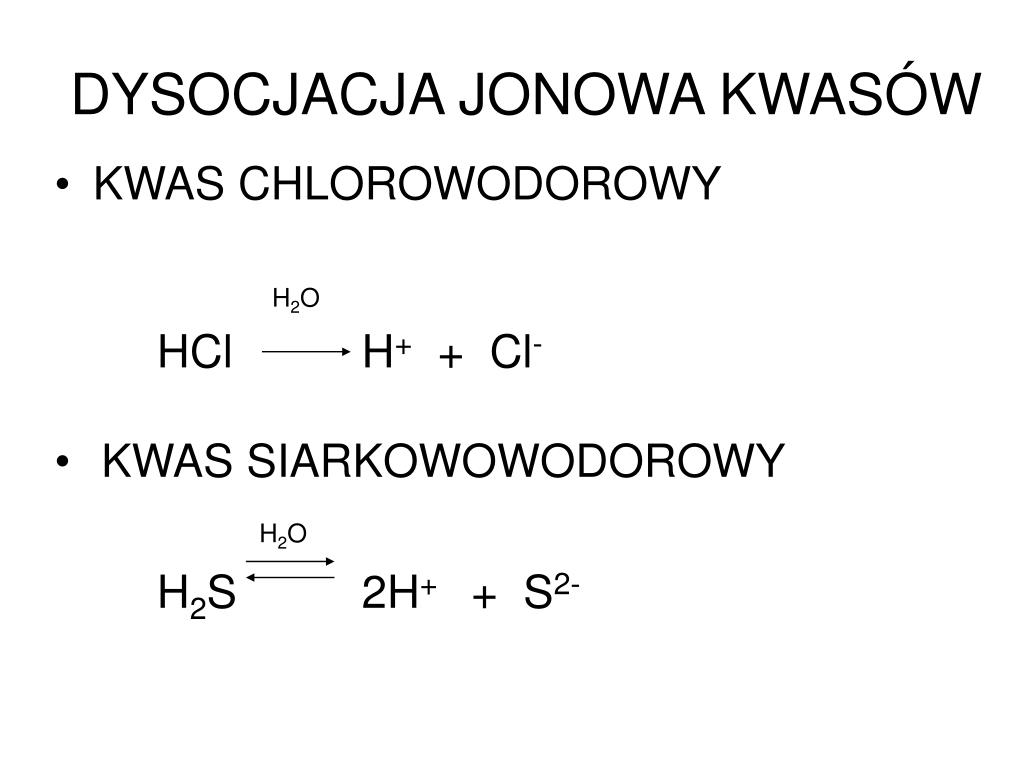
Zanim przejdziemy do konkretów, przypomnijmy sobie, czym jest dysocjacja kwasu w ogóle. Mówiąc najprościej, to proces, w którym cząsteczka kwasu rozpada się w wodzie na jony. W przypadku kwasu mrówkowego (HCOOH) wygląda to tak:
HCOOH (aq) ⇌ H+ (aq) + HCOO- (aq)
Czyli, kwas mrówkowy w roztworze wodnym rozpada się na jon wodorowy (H+), który odpowiada za kwasowy charakter roztworu, oraz jon mrówczanowy (HCOO-), który jest jego sprzężoną zasadą. Strzałka w obie strony (⇌) oznacza, że reakcja jest odwracalna, co oznacza, że dysocjacja nie zachodzi w 100% - część cząsteczek kwasu mrówkowego pozostaje w postaci niezjonizowanej.
Stała Dysocjacji Kwasu (Ka)
Aby opisać siłę kwasu, czyli jego zdolność do dysocjacji, używamy stałej dysocjacji kwasu (Ka). Im wyższa wartość Ka, tym silniejszy kwas, czyli tym większa część cząsteczek ulega dysocjacji. Dla kwasu mrówkowego Ka wynosi około 1.8 x 10-4. To oznacza, że jest to słaby kwas. Dla porównania, mocne kwasy, takie jak kwas solny (HCl), mają Ka bardzo duże (praktycznie nieskończone).
Wartość Ka mówi nam, jak bardzo kwas jest "chętny" do oddawania protonów. Wyższa wartość Ka = większa chęć = silniejszy kwas.
Czynniki Wpływające na Dysocjację Kwasu Mrówkowego
Na stopień dysocjacji kwasu mrówkowego wpływa kilka czynników:
- Temperatura: Zazwyczaj wyższa temperatura sprzyja dysocjacji, chociaż wpływ ten nie jest bardzo silny w przypadku kwasu mrówkowego.
- Stężenie: Im wyższe stężenie kwasu, tym mniejszy stopień dysocjacji (Prawo Rozcieńczeń Ostwalda). Dzieje się tak dlatego, że jony H+ i HCOO- trudniej "rozprowadzić" w roztworze, co utrudnia dysocjację kolejnych cząsteczek.
- Obecność innych jonów: Dodatek innych jonów do roztworu może wpływać na równowagę dysocjacji. Na przykład, dodatek mrówczanu sodu (HCOONa) spowoduje przesunięcie równowagi w lewo, zmniejszając stopień dysocjacji kwasu mrówkowego (efekt wspólnego jonu).
- Siła jonowa roztworu: Im wyższa siła jonowa roztworu, tym bardziej jony są otoczone warstwą jonową, co wpływa na ich aktywność i równowagę reakcji dysocjacji.
Przykłady Z Życia
Wyobraź sobie, że chcesz zakonserwować ogórki kiszone. Dodajesz do zalewy ocet (który zawiera kwas octowy, podobny do kwasu mrówkowego) i sól. Sól, zwiększając siłę jonową, wpływa na dysocjację kwasu octowego, co z kolei wpływa na pH zalewy i skuteczność konserwacji. Zbyt mała ilość kwasu (za wysokie pH) spowoduje, że ogórki się zepsują. Zbyt duża ilość (za niskie pH) sprawi, że będą zbyt kwaśne i niezjadliwe.
Kontrowersje i Alternatywne Poglądy
Chociaż dysocjacja kwasów jest dobrze zbadanym procesem, istnieją pewne punkty sporne i alternatywne interpretacje. Niektórzy badacze podkreślają znaczenie efektów rozpuszczalnikowych, czyli wpływu struktury i właściwości wody na proces dysocjacji. Inni zwracają uwagę na tworzenie się asocjatów jonowych, czyli par jonów, które nie są w pełni rozdzielone. Te aspekty są szczególnie istotne w roztworach o dużym stężeniu.
Częstym argumentem jest również uproszczenie modelu dysocjacji, który zakłada idealne zachowanie roztworów. W rzeczywistości, interakcje między jonami a cząsteczkami rozpuszczalnika są bardziej skomplikowane i mogą wpływać na wartość Ka. Dlatego, szczególnie w przypadku precyzyjnych obliczeń, należy uwzględniać współczynniki aktywności jonów, które korygują odchylenia od idealnego zachowania.
Praktyczne Zastosowania Zrozumienia Dysocjacji Kwasu Mrówkowego
Zrozumienie mechanizmów dysocjacji kwasu mrówkowego otwiera drzwi do wielu praktycznych zastosowań:
- Optymalizacja procesów przemysłowych: Lepsza kontrola pH pozwala na efektywniejsze wykorzystanie kwasu mrówkowego jako konserwantu, środka zakwaszającego lub reagenta.
- Projektowanie nowych materiałów: Wiedza o dysocjacji kwasów może być wykorzystana do syntezy polimerów wrażliwych na pH, które zmieniają swoje właściwości w zależności od pH otoczenia.
- Rozwój metod analitycznych: Zrozumienie równowag kwasowo-zasadowych jest kluczowe do opracowywania nowych metod oznaczania stężenia kwasu mrówkowego i innych substancji.
- Ochrona środowiska: Poznanie wpływu kwasu mrówkowego na ekosystemy pozwala na opracowywanie strategii minimalizujących jego negatywny wpływ.
Podsumowanie i Co Dalej?
Mam nadzieję, że udało mi się przybliżyć Ci temat dysocjacji kwasu mrówkowego i pokazać, że wcale nie jest to takie skomplikowane, jak mogło się wydawać na początku. Pamiętaj, że chemia to przede wszystkim zrozumienie zasad i zależności, a nie tylko zapamiętywanie wzorów i definicji.
Kluczowe aspekty, które omówiliśmy:
- Dysocjacja kwasu mrówkowego to rozpad na jony H+ i HCOO- w roztworze wodnym.
- Stała dysocjacji Ka określa siłę kwasu.
- Na dysocjację wpływają temperatura, stężenie, obecność innych jonów i siła jonowa roztworu.
- Zrozumienie dysocjacji ma praktyczne zastosowania w przemyśle, rolnictwie, ochronie środowiska i wielu innych dziedzinach.
Teraz, kiedy masz solidne podstawy, możesz pójść krok dalej:
- Przeczytaj więcej o równowagach kwasowo-zasadowych.
- Wykonaj proste eksperymenty, np. zmierz pH roztworu kwasu mrówkowego o różnym stężeniu.
- Zastanów się, w jaki sposób wiedza o dysocjacji kwasów może być przydatna w Twojej dziedzinie zainteresowań.
Czy masz jakieś pytania dotyczące dysocjacji kwasu mrówkowego lub innych zagadnień chemicznych? A może masz przykład z życia, gdzie ta wiedza okazała się przydatna? Podziel się swoimi przemyśleniami!