Dysocjacja Kwasów Zasad I Soli

Rozumiemy, że chemia, a zwłaszcza tematy takie jak dysocjacja kwasów, zasad i soli, mogą wydawać się z początku skomplikowane i abstrakcyjne. Może to budzić frustrację, zwłaszcza gdy widzimy, jak bardzo te procesy wpływają na codzienne życie, choć na pierwszy rzut oka wydaje się to nieoczywiste. W tym artykule postaramy się wyjaśnić te zagadnienia w prosty i przystępny sposób, pokazując ich praktyczne zastosowanie i wpływ na otaczający nas świat.
Dysocjacja: Co to właściwie jest?
Dysocjacja, najprościej mówiąc, to rozpad związku chemicznego na jony w roztworze. Wyobraźmy sobie sól kuchenną (NaCl) wrzuconą do wody. Zamiast kryształów soli, otrzymujemy rozproszone jony sodu (Na+) i jony chlorkowe (Cl-). To właśnie jest dysocjacja.
Dlaczego to się dzieje? Woda, jako rozpuszczalnik polarny, ma cząsteczki o nierównomiernym rozkładzie ładunku. Te cząsteczki wody otaczają i oddzielają jony, pokonując siły elektrostatyczne trzymające je razem w krysztale soli.
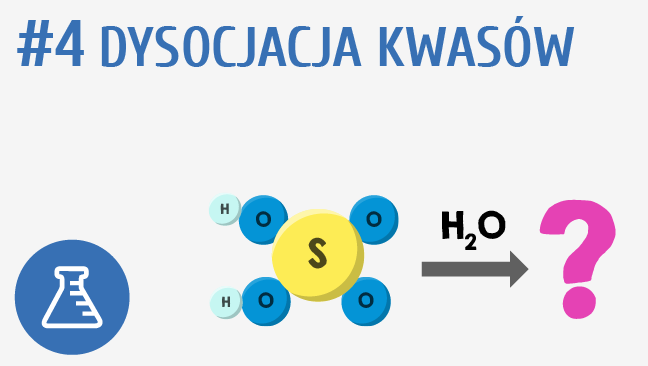
Dysocjacja Kwasów
Kwasy, według teorii Arrheniusa, to substancje, które w roztworze wodnym dysocjują, tworząc jony wodorowe (H+). Bardziej precyzyjnie, jony H+ łączą się z wodą, tworząc jony hydroniowe (H3O+).
Mocne i Słabe Kwasy
Nie wszystkie kwasy dysocjują w takim samym stopniu. Dzielimy je na:
- Kwasy mocne: Dysocjują całkowicie lub prawie całkowicie w wodzie. Przykładem jest kwas solny (HCl). Reakcja dysocjacji wygląda następująco: HCl → H+ + Cl- (w rzeczywistości HCl + H2O → H3O+ + Cl-). Oznacza to, że w roztworze kwasu solnego prawie nie ma cząsteczek HCl – są tam głównie jony H+ i Cl-.
- Kwasy słabe: Dysocjują tylko częściowo. Przykładem jest kwas octowy (CH3COOH). Reakcja dysocjacji wygląda następująco: CH3COOH ⇌ CH3COO- + H+ (w rzeczywistości CH3COOH + H2O ⇌ CH3COO- + H3O+). Strzałka dwukierunkowa (⇌) oznacza, że reakcja jest odwracalna, co oznacza, że w roztworze kwasu octowego znajdują się zarówno jony octanowe (CH3COO-) i wodorowe (H+), jak i niezdysocjowane cząsteczki kwasu octowego (CH3COOH).
Wartość pH roztworu kwasu informuje nas o stężeniu jonów H+. Im niższe pH, tym wyższe stężenie jonów H+ i tym mocniejszy kwas.
Real-world impact: Kwasy są obecne w wielu aspektach naszego życia. Kwas askorbinowy (witamina C) jest niezbędny dla naszego zdrowia, kwas octowy (ocet) używamy w kuchni, a kwas siarkowy w akumulatorach samochodowych.
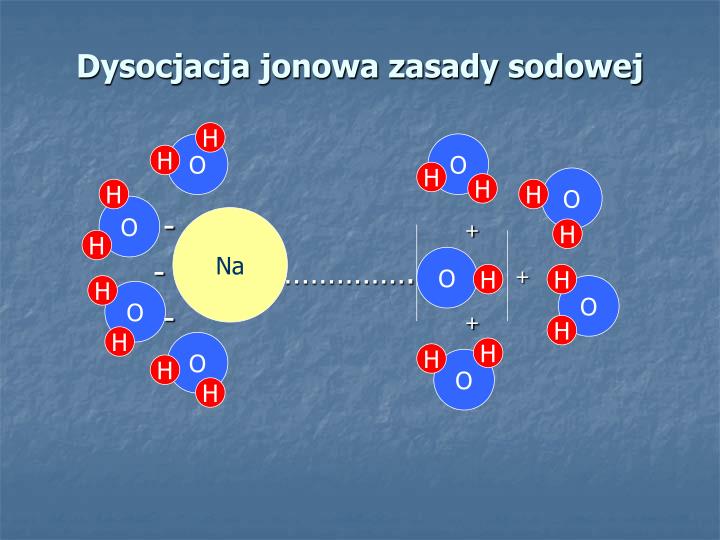
Dysocjacja Zasad
Zasady (lub wodorotlenki) to związki, które w roztworze wodnym dysocjują, tworząc jony wodorotlenkowe (OH-).
Mocne i Słabe Zasady
Podobnie jak kwasy, zasady dzielimy na mocne i słabe:
- Zasady mocne: Dysocjują całkowicie lub prawie całkowicie w wodzie. Przykładem jest wodorotlenek sodu (NaOH). Reakcja dysocjacji wygląda następująco: NaOH → Na+ + OH-.
- Zasady słabe: Dysocjują tylko częściowo. Przykładem jest amoniak (NH3), który reaguje z wodą: NH3 + H2O ⇌ NH4+ + OH-.
Wartość pH roztworu zasady informuje nas o stężeniu jonów OH-. Im wyższe pH, tym wyższe stężenie jonów OH- i tym mocniejsza zasada.
Real-world impact: Wodorotlenek sodu (soda kaustyczna) używany jest do udrażniania rur, a wodorotlenek wapnia (wapno gaszone) w budownictwie.
Dysocjacja Soli
Sole to związki chemiczne powstałe w wyniku reakcji kwasu z zasadą (reakcja zobojętniania). Dysocjacja soli polega na rozpadzie na kationy (jony dodatnie) i aniony (jony ujemne).
Przykładem jest chlorek sodu (NaCl), który dysocjuje na jony sodu (Na+) i jony chlorkowe (Cl-): NaCl → Na+ + Cl-.
Stopień dysocjacji soli zależy od:
- Rodzaju soli: Niektóre sole dysocjują łatwiej niż inne.
- Temperatury: Zazwyczaj wyższa temperatura sprzyja dysocjacji.
- Rozpuszczalnika: Dysocjacja zachodzi głównie w rozpuszczalnikach polarnych, takich jak woda.
Real-world impact: Sole odgrywają kluczową rolę w procesach fizjologicznych. Jony sodu, potasu i chlorkowe są niezbędne do funkcjonowania komórek nerwowych i mięśniowych. Sole mineralne są również ważne dla wzrostu roślin.
Przeciwstawne poglądy i obawy
Niektórzy mogą argumentować, że szczegółowe zrozumienie dysocjacji jest potrzebne tylko chemikom. Chociaż zgadzamy się, że szczegółowa wiedza jest niezbędna dla specjalistów, fundamentalne zrozumienie tego procesu pozwala lepiej interpretować informacje o pH, składzie wód mineralnych, a nawet skuteczności środków czyszczących. Rozumiejąc, że dysocjacja wpływa na reaktywność chemiczną, jesteśmy w stanie bardziej świadomie podchodzić do codziennych czynności.
Istnieją również obawy, że zbyt proste tłumaczenie skomplikowanych procesów chemicznych może prowadzić do uproszczeń i błędnych interpretacji. Dlatego staramy się przedstawić te zagadnienia w sposób przystępny, ale jednocześnie rzetelny, zachęcając do dalszego pogłębiania wiedzy w oparciu o sprawdzone źródła.
Praktyczne Zastosowania i rozwiązania
Zrozumienie dysocjacji ma wiele praktycznych zastosowań:
- Kontrola pH: W rolnictwie, przemyśle spożywczym i farmaceutycznym ważne jest utrzymanie odpowiedniego pH, co wymaga znajomości dysocjacji kwasów i zasad.
- Uzdatnianie wody: Procesy uzdatniania wody opierają się na wykorzystaniu reakcji dysocjacji i strącania jonów.
- Analiza chemiczna: Metody analizy chemicznej, takie jak miareczkowanie, wykorzystują reakcje kwasowo-zasadowe i związane z nimi procesy dysocjacji.
- Procesy biologiczne: Enzymy, które katalizują reakcje biochemiczne, często działają w specyficznych zakresach pH, co ma związek z dysocjacją grup funkcyjnych aminokwasów.
Rozwiązaniem dla trudności w zrozumieniu dysocjacji jest:
- Wizualizacja: Używanie modeli i symulacji komputerowych, aby zobaczyć, jak cząsteczki i jony poruszają się w roztworze.
- Ćwiczenia praktyczne: Przeprowadzanie prostych eksperymentów, takich jak mierzenie pH różnych roztworów.
- Dostępne zasoby: Korzystanie z interaktywnych zasobów online i edukacyjnych filmów.
Podsumowanie i Co Dalej?
Mamy nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć proces dysocjacji kwasów, zasad i soli. Pamiętaj, że chemia jest fascynującą dziedziną, która ma ogromny wpływ na nasze życie. Zrozumienie podstawowych zasad, takich jak dysocjacja, otwiera drzwi do głębszego poznania świata wokół nas.
Teraz Twoja kolej! Czy masz pytania dotyczące konkretnych aspektów dysocjacji? A może chciałbyś dowiedzieć się więcej o jej zastosowaniach w konkretnej dziedzinie? Zachęcamy do dalszego zgłębiania wiedzy i eksperymentowania. Spróbuj samodzielnie zmierzyć pH różnych roztworów, np. soku z cytryny, octu, wody z mydłem. To doskonały sposób na praktyczne wykorzystanie wiedzy zdobytej w tym artykule.