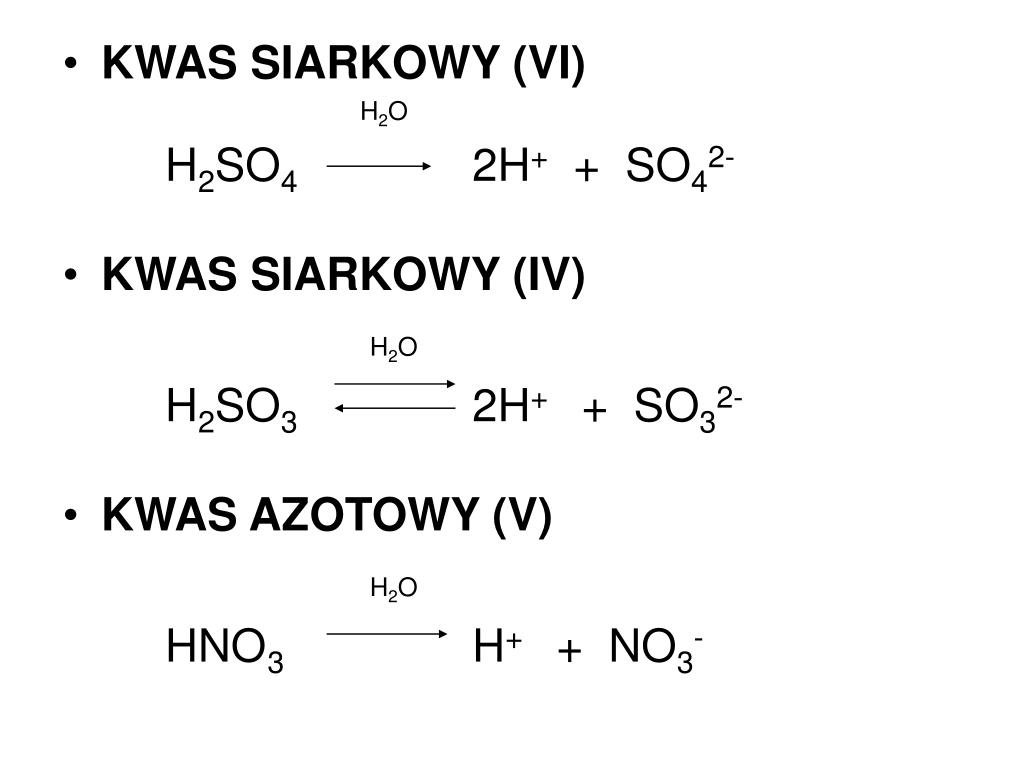
Dysocjacja Jonowa Kwasu Azotowego V
Hej! Dziś zajmiemy się fascynującym procesem chemicznym zwanym dysocjacją jonową, a naszym modelem będzie mocny kwas: kwas azotowy(V), znany również jako HNO3. Spróbujemy zrozumieć, co się dzieje, kiedy ten kwas trafia do wody i jak to wpływa na jego właściwości. Przygotuj się na wizualizacje, porównania i przykłady, które ułatwią Ci zrozumienie tematu!
Co to jest Dysocjacja Jonowa? Wyobraź sobie Rozwód na Poziomie Molekularnym!
Wyobraź sobie parę, która jest bardzo mocno związana (powiedzmy, że to H i NO3 w HNO3). Razem tworzą stabilną jednostkę. Ale co się stanie, gdy para ta znajdzie się w otoczeniu, które jest "bardziej atrakcyjne" dla jednej ze stron? W przypadku dysocjacji jonowej, takim otoczeniem jest woda (H2O). Woda jest jak swarliwy swatka, która "namawia" jedną ze stron do opuszczenia związku.
Dysocjacja jonowa to proces, w którym cząsteczka (w naszym przypadku kwasu azotowego(V)) rozkłada się na jony – cząstki naładowane elektrycznie. Zamiast neutralnej cząsteczki HNO3, mamy teraz naładowane cząstki: jon wodorowy (H+) i jon azotanowy(V) (NO3-).
W skrócie: Dysocjacja jonowa = Rozpad cząsteczki na jony pod wpływem rozpuszczalnika (najczęściej wody).
Wyobraź to sobie:
HNO3 (w wodzie) → H+ + NO3-
Jak Woda Pomaga w "Rozwodzie"? – Elektroujemność i Dipole
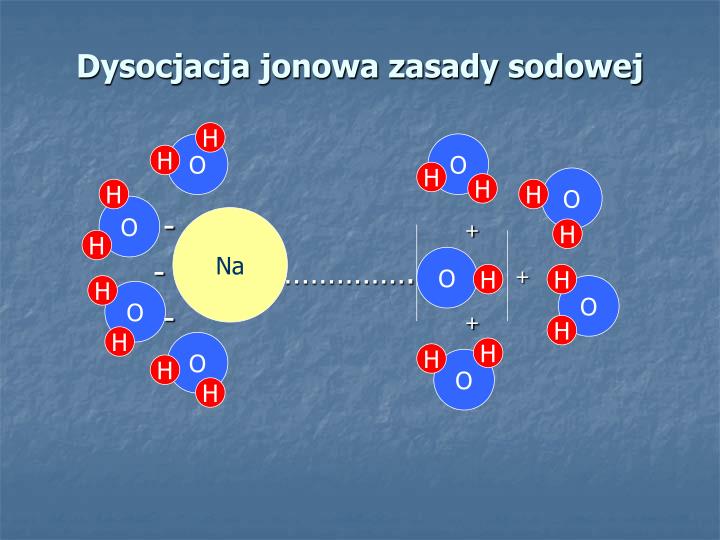
Woda jest niezwykła dzięki swojej polarności. Oznacza to, że w cząsteczce wody (H2O) atomy tlenu są bardziej elektroujemne niż atomy wodoru. Elektroujemność to "zdolność" atomu do przyciągania elektronów. Tlen "kradnie" trochę elektronów wodorowi, co powoduje, że tlen ma lekką ujemną ładunek (δ-) a wodory lekkie dodatnie ładunki (δ+). Powstają więc dipol dodatni i dipol ujemny w cząsteczce wody.
Te dodatnie i ujemne "końce" cząsteczek wody otaczają cząsteczkę kwasu azotowego(V). Dodatnie wodory w wodzie "przyciągają" ujemnie naładowany jon azotanowy(V) (NO3-), a ujemny tlen w wodzie "przyciąga" dodatnio naładowany jon wodorowy (H+). To osłabia wiązanie między H+ i NO3-, prowadząc do rozpadu cząsteczki kwasu na jony.
Wizualizacja: Wyobraź sobie magnes. Woda to masa małych magnesów, niektóre z biegunem dodatnim skierowanym na zewnątrz, a inne z biegunem ujemnym. Te magnesy otaczają HNO3 i "odrywają" od siebie H+ i NO3-.
Kwas Azotowy(V) – Król Dysocjacji!
Kwas azotowy(V) (HNO3) jest mocnym kwasem. Co to oznacza? Oznacza to, że w wodzie dysocjuje całkowicie (lub prawie całkowicie). Inaczej mówiąc, prawie każda cząsteczka HNO3 rozpada się na jony H+ i NO3-.
Porównanie: Wyobraź sobie dwa budynki mieszkalne. W jednym mieszkają "słabe" kwasy, które rozpadają się na jony tylko w małym stopniu. W drugim mieszkają "mocne" kwasy, takie jak HNO3, które rozpadają się całkowicie. W budynku "mocnych" kwasów prawie wszystkie mieszkania są puste (czyli wszystkie cząsteczki rozpadły się na jony), a mieszkańcy spacerują po okolicy (jony są wolne w roztworze).
W konsekwencji: Roztwór kwasu azotowego(V) zawiera bardzo dużo jonów H+. Jony H+ są odpowiedzialne za kwasowe właściwości roztworu. Dlatego im więcej jonów H+, tym roztwór jest bardziej kwasowy (czyli ma niższe pH).
Realne Zastosowania i Znaczenie Dysocjacji
Dysocjacja jonowa kwasu azotowego(V) ma ogromne znaczenie w wielu dziedzinach:
- Laboratorium chemiczne: HNO3 jest używany jako odczynnik w wielu reakcjach chemicznych. Jego zdolność do dysocjacji na jony pozwala na przeprowadzanie reakcji z udziałem jonów H+.
- Przemysł nawozowy: HNO3 jest używany do produkcji nawozów sztucznych, dostarczając roślinom azot niezbędny do wzrostu.
- Produkcja materiałów wybuchowych: Niestety, HNO3 jest także składnikiem materiałów wybuchowych (np. nitrogliceryny), gdzie jego właściwości utleniające odgrywają kluczową rolę.
- Badania naukowe: Pomiar stopnia dysocjacji różnych substancji jest ważny w badaniach nad właściwościami roztworów i reakcjami chemicznymi.
Podsumowując: Dysocjacja jonowa kwasu azotowego(V) to proces rozpadu cząsteczki HNO3 na jony H+ i NO3- pod wpływem wody. Jest to charakterystyczne dla mocnych kwasów, a obecność dużej ilości jonów H+ nadaje roztworowi właściwości kwasowe. Zrozumienie tego procesu jest kluczowe do zrozumienia wielu zjawisk chemicznych i zastosowań praktycznych.
Mam nadzieję, że to wyjaśnienie było pomocne! Powodzenia w dalszej nauce chemii!



+Otrzymywanie:+N2O5+%2B+H2O+2+HNO3.jpg)



