Dysocjacja Jonowa Kwasów Karboksylowych

Kwas karboksylowy. Sama nazwa brzmi trochę... groźnie, prawda? Kojarzy się z chemią, laboratorium i tym wszystkim, co większość z nas pamięta z lekcji, starając się jednocześnie zapomnieć.
Ale! Spokojnie. Dziś rozłożymy go na czynniki pierwsze... dosłownie! A konkretnie, pogadamy o jego dysocjacji jonowej. Brzmi strasznie naukowo? No pewnie, że brzmi. Ale obiecuję, że będzie zabawnie (przynajmniej spróbuję!).
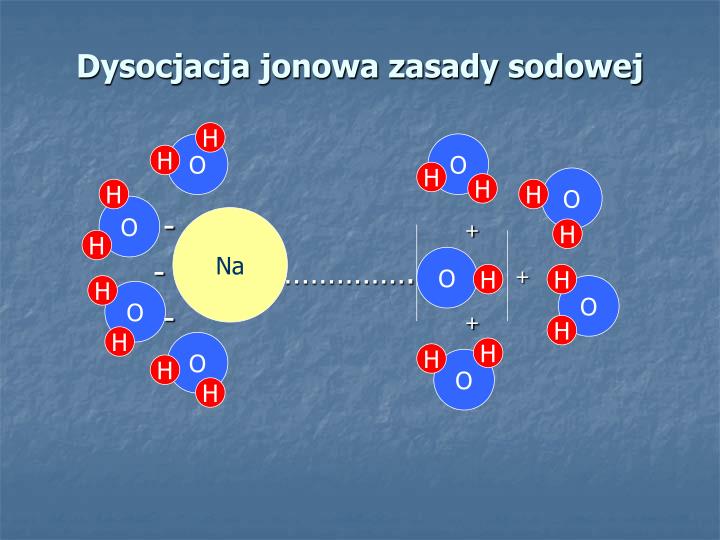
Wyobraź sobie, że kwas karboksylowy to taka trochę rozkapryszona gwiazda pop. Ona chce być wolna! Ona chce się rozdzielić! I właśnie to robi w wodzie.
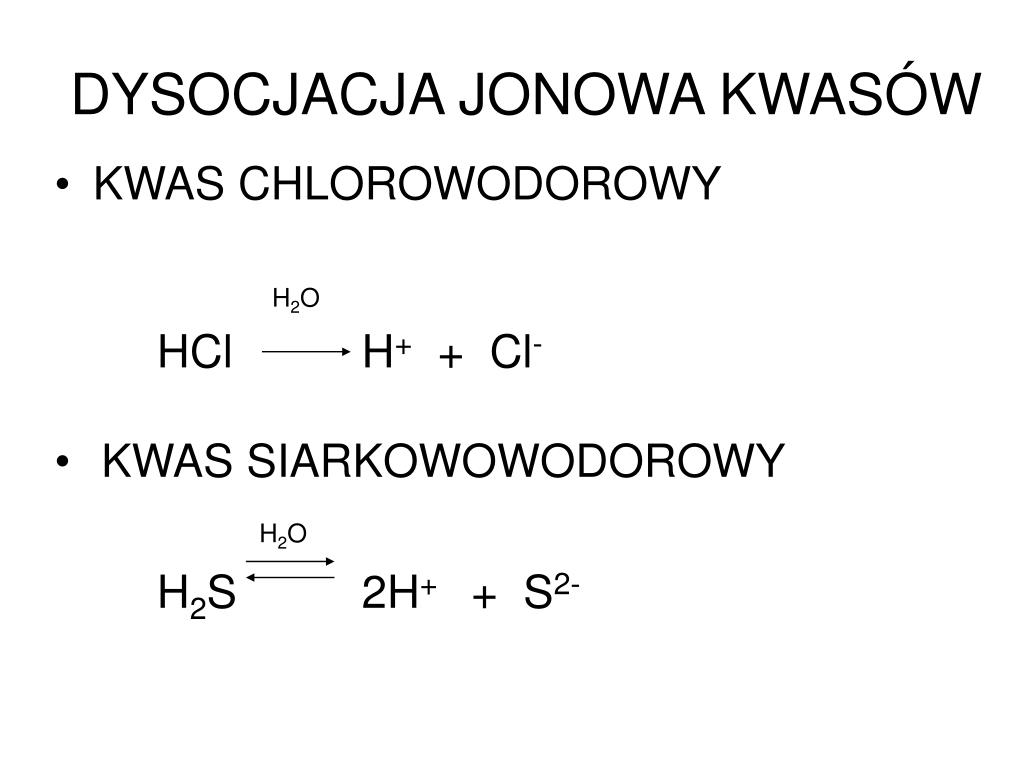
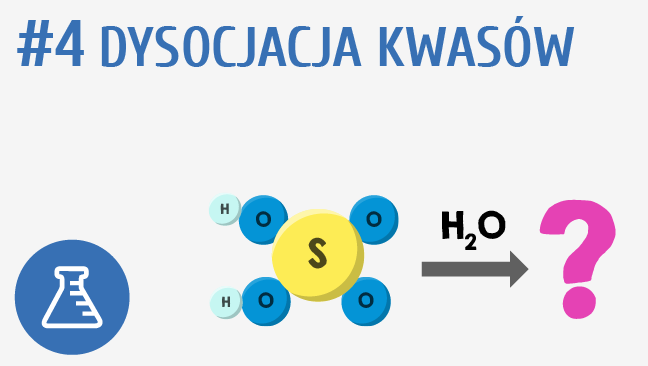
Cały proces dysocjacji to po prostu rozpad. Nasza gwiazda, czyli kwas, rozpada się na dwie części. Na jon wodorowy (H+), czyli taki mały, ale wredny kwasowy "bąbelek", który odpowiada za kwaśny smak (np. w cytrynie) i anion karboksylanowy, czyli resztę naszej gwiazdy, trochę spokojniejszą i bardziej poukładaną.
Dlaczego to robi? Dobre pytanie! Dlatego, że tak jest... łatwiej! W wodzie, kwas karboksylowy czuje się lepiej, kiedy jest podzielony. Taka chemia. Skomplikowane? Odrobinkę. Potrzebne do życia? Absolutnie tak!
Siła ma znaczenie... ale nie zawsze!
Teraz dochodzimy do sedna. Nie wszystkie kwasy karboksylowe chcą się rozpadać z takim samym entuzjazmem. Niektóre są bardziej... uparte. To zależy od tego, jak bardzo stabilny jest ich anion karboksylanowy. Im stabilniejszy, tym łatwiej kwas oddaje swój wodorowy "bąbelek" i staje się silniejszy.
Pomyśl o tym tak: masz dwa magnesy. Jeden bardzo silny, drugi słaby. Silny magnes łatwo odepchnie mały kawałek metalu. Słaby magnes będzie potrzebował więcej wysiłku. Podobnie jest z kwasami. Silny kwas łatwo oddaje H+, słaby kwas musi się bardziej postarać.
Unpopular opinion: Kwasy karboksylowe to niedoceniani bohaterowie!
No dobra, teraz moja kontrowersyjna opinia. Uważam, że kwasy karboksylowe są niedoceniane! Serio! Bez nich nie byłoby octu (który ratuje życie w wielu sytuacjach!), nie byłoby witaminy C (która chroni nas przed przeziębieniem), nie byłoby wielu leków (które... leczą!).
Naprawdę! One są wszędzie! W jedzeniu, w kosmetykach, w przemyśle. A my często o nich zapominamy! To trochę tak, jak z cichym bohaterem filmu, który ratuje świat, ale nikt mu nie dziękuje.
Może to czas, żeby docenić kwasy karboksylowe? Chociaż trochę!
A dysocjacja jonowa? No cóż, to tylko sposób, w jaki te wspaniałe związki chemiczne radzą sobie w wodnym świecie. Trochę jak my, kiedy próbujemy się dostosować do nowej sytuacji. Jedni radzą sobie lepiej, inni gorzej. Ale ostatecznie, jakoś to idzie!
Więc następnym razem, kiedy poczujesz kwaśny smak cytryny, pomyśl o dysocjacji jonowej. Pomyśl o tych małych H+, które pływają w wodzie i robią całą robotę. I może nawet uśmiechnij się. Bo chemia wcale nie musi być nudna! A kwasy karboksylowe na pewno na to nie zasługują.
P.S. Nie próbuj rozdzielać kwasu karboksylowego w domu. To zadanie dla profesjonalistów (i wody!).