Dlaczego Benzen Nie Odbarwia Wody Bromowej
Wiele organicznych związków chemicznych reaguje z wodą bromową, powodując jej odbarwienie. Ta reakcja jest często wykorzystywana jako test na obecność wiązań nienasyconych (podwójnych lub potrójnych) w cząsteczce. Jednak benzen, mimo że zawiera wiązania, które na pierwszy rzut oka wydają się podwójne, *nie* odbarwia wody bromowej w typowych warunkach. Dlaczego tak się dzieje? Niniejszy artykuł wyjaśni tę pozorną sprzeczność krok po kroku.
Co to jest woda bromowa i dlaczego odbarwia?
Woda bromowa to roztwór bromu (Br2) w wodzie. Brom ma charakterystyczny, brązowo-żółty kolor. Kiedy związek organiczny zawierający wiązanie nienasycone reaguje z bromem, brom "dodaje się" do tego wiązania, przekształcając wiązanie podwójne lub potrójne w wiązanie pojedyncze. Ta reakcja nazywana jest addycją elektrofilową. Ponieważ brom jest zużywany w reakcji, jego stężenie w roztworze maleje, a w konsekwencji roztwór traci swój kolor – odbarwia się.
Prosty przykład to reakcja etenu (CH2=CH2) z wodą bromową:
CH2=CH2 + Br2 → CH2Br-CH2Br
W tym przypadku etylen reaguje z bromem, tworząc 1,2-dibromoetan. Zauważ, że wiązanie podwójne w etenie zostało przerwane, a atomy bromu przyłączyły się do atomów węgla.
Struktura benzenu: Pozory mylą
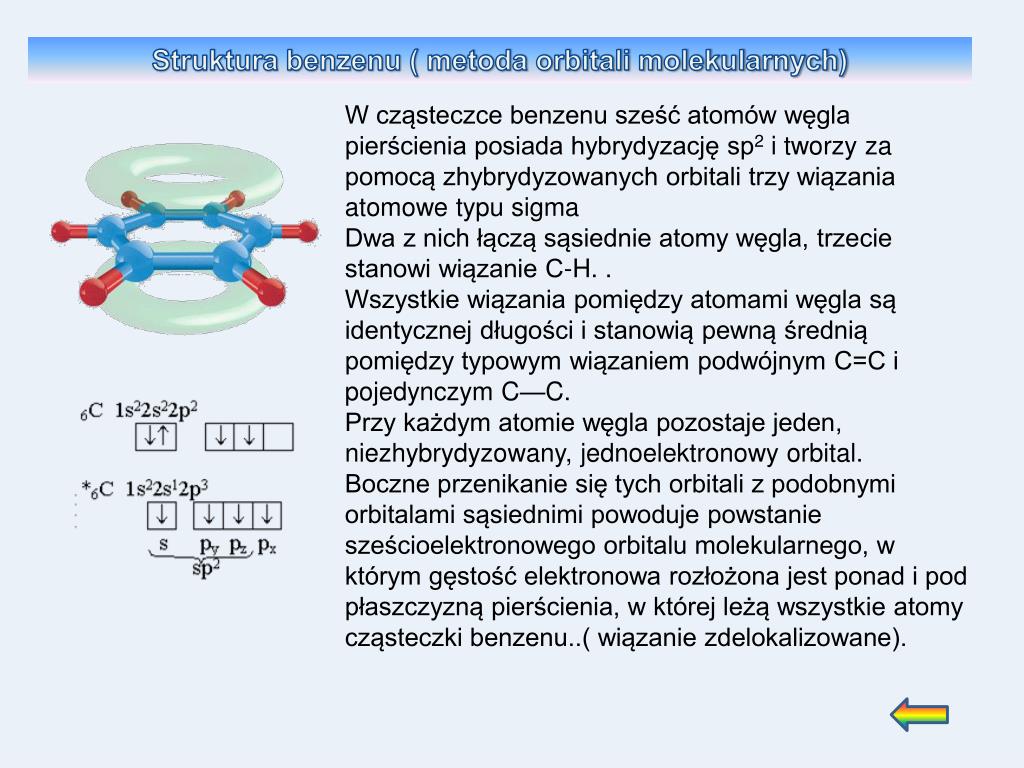
Benzen (C6H6) ma sześć atomów węgla połączonych w pierścień. Każdy atom węgla jest związany z jednym atomem wodoru. Tradycyjnie, strukturę benzenu przedstawia się z naprzemiennymi wiązaniami pojedynczymi i podwójnymi między atomami węgla. Wygląda to więc tak, jakby benzen zawierał trzy wiązania podwójne, podobnie jak etylen. To jednak tylko *pozór*.
Rzeczywista struktura benzenu jest bardziej skomplikowana i lepiej opisana przez koncepcję rezonansu. Oznacza to, że elektrony π (te tworzące wiązania podwójne) nie są zlokalizowane pomiędzy dwoma konkretnymi atomami węgla, ale są delokalizowane w całym pierścieniu. Innymi słowy, elektrony π są równomiernie rozłożone wokół pierścienia benzenu, tworząc rodzaj "chmury elektronowej" powyżej i poniżej płaszczyzny pierścienia. To właśnie ta delokalizacja elektronów nadaje benzenowi wyjątkową stabilność, znacznie większą niż stabilność cykloheksanu z trzema zlokalizowanymi wiązaniami podwójnymi.
Symbolicznie przedstawiamy to poprzez rysowanie okręgu wewnątrz pierścienia sześciokątnego, aby wskazać delokalizację elektronów:

Dlaczego benzen nie reaguje z wodą bromową w normalnych warunkach?
Stabilność benzenu wynikająca z delokalizacji elektronów sprawia, że jest on znacznie *mniej reaktywny* niż alkeny (związki z wiązaniami podwójnymi). Zamiast typowej addycji elektrofilowej, która zniszczyłaby pierścień aromatyczny i kosztowną energetycznie delokalizację, benzen preferuje reakcje, które zachowują pierścień, czyli substytucję elektrofilową.
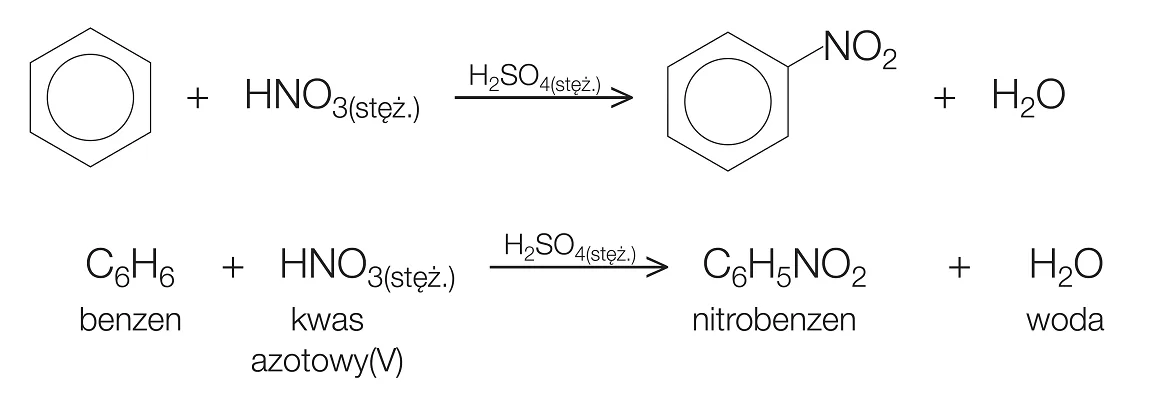
W normalnych warunkach, aby benzen zareagował z wodą bromową, potrzebny jest katalizator, taki jak żelazo(III) bromek (FeBr3). Katalizator ten pełni rolę kwasu Lewisa, aktywując cząsteczkę bromu i czyniąc ją bardziej elektrofilową.
Mechanizm reakcji wygląda następująco:
- Tworzenie elektrofilu: FeBr3 reaguje z Br2, tworząc silniejszy elektrofil, Br+.
- Atak elektrofilowy: Elektrofil atakuje pierścień benzenu.
- Powstawanie jonu arenioniowego: Powstaje niestabilny jon arenioniowy (zwany również kompleksem σ), w którym wiązanie podwójne jest przejściowo zlokalizowane.
- Eliminacja protonu: Atom wodoru jest usuwany z pierścienia, odtwarzając delokalizację elektronów i tworząc bromobenzen.
Ostatecznie, reakcja prowadzi do substytucji atomu wodoru atomem bromu, a nie do addycji do wiązania podwójnego. W efekcie woda bromowa *nie* odbarwia się, ponieważ brom jest przekształcany w bromobenzen, który jest bezbarwny, ale reakcja przebiega z udziałem katalizatora, a nie samorzutnie, jak w przypadku alkenów. Sama woda bromowa bez katalizatora nie jest wystarczająco reaktywna, aby przerwać stabilny pierścień benzenowy.
Podsumowanie
Podsumowując, benzen nie odbarwia wody bromowej w typowych warunkach, ponieważ:
- Jego struktura jest unikalna i charakteryzuje się delokalizacją elektronów, co nadaje mu wyjątkową stabilność.
- Wiązania, które na pierwszy rzut oka wydają się podwójne, w rzeczywistości są zdelokalizowane i *nie* reagują łatwo w reakcjach addycji.
- Benzen preferuje reakcje substytucji elektrofilowej, które zachowują pierścień aromatyczny, zamiast reakcji addycji, które go niszczą.
- Do reakcji benzenu z bromem wymagany jest katalizator, który zwiększa reaktywność bromu.
Zrozumienie tego zjawiska jest kluczowe dla zrozumienia chemii związków aromatycznych i różnic w reaktywności między różnymi rodzajami wiązań nienasyconych.