Co To Jest Konfiguracja Elektronowa Atomów

Czy zastanawiałeś się kiedyś, dlaczego niektóre pierwiastki są tak aktywne chemicznie, a inne obojętne? Albo dlaczego miedź przewodzi prąd, a diament jest tak twardy? Kluczem do zrozumienia tych różnic jest konfiguracja elektronowa atomów – swoiste "rozmieszczenie" elektronów wokół jądra, które dyktuje zachowanie pierwiastka. Ten artykuł, przeznaczony dla osób z podstawową wiedzą z zakresu chemii, w przystępny sposób wyjaśni, czym jest konfiguracja elektronowa, jak ją ustalić i dlaczego jest tak ważna.
Czym Jest Konfiguracja Elektronowa?
Konfiguracja elektronowa to nic innego jak opis rozmieszczenia elektronów w atomie na poszczególnych powłokach elektronowych i podpowłokach. Wyobraźmy sobie atom jako stadion, na którym krążą elektrony. Powłoki elektronowe to kolejne trybuny, a podpowłoki to poszczególne sektory na tych trybunach. Każdy "sektor" (orbital) może pomieścić maksymalnie dwa elektrony. Zrozumienie tej struktury jest fundamentalne dla przewidywania właściwości chemicznych pierwiastków.
Mówiąc bardziej formalnie, konfiguracja elektronowa atomu opisuje, które orbitale atomowe są zajęte przez elektrony i ile elektronów znajduje się na każdym z tych orbitali. Ta konfiguracja determinuje wiele właściwości atomu, w tym jego wielkość, energię jonizacji (energię potrzebną do oderwania elektronu), powinowactwo elektronowe (zdolność do przyjmowania elektronu) oraz sposób, w jaki atom reaguje z innymi atomami, tworząc związki chemiczne.
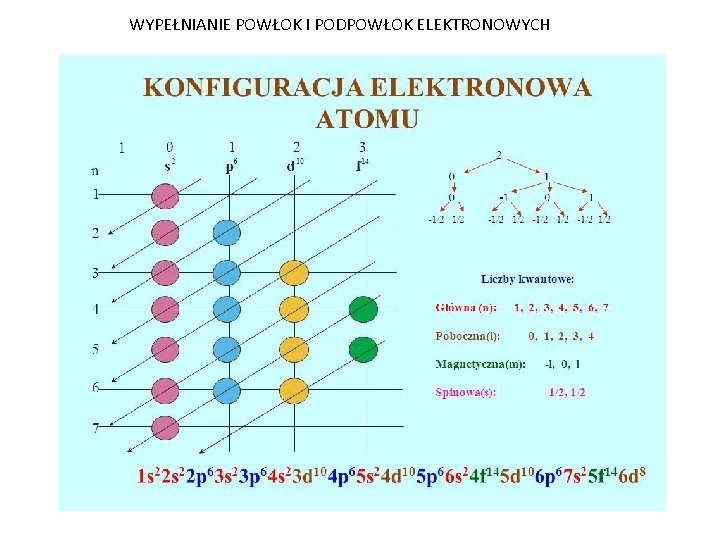
Powłoki Elektronowe i Liczby Kwantowe
Elektrony w atomie nie krążą wokół jądra w sposób przypadkowy. Ich rozmieszczenie podlega pewnym regułom, które opisują liczby kwantowe. Te liczby kwantowe to:
- Główna liczba kwantowa (n): Określa numer powłoki elektronowej (n = 1, 2, 3, ...). Im wyższa wartość n, tym dalsza od jądra jest powłoka i tym wyższa jest energia elektronów na tej powłoce. Powłoka n=1 nazywana jest powłoką K, n=2 to powłoka L, n=3 to powłoka M, i tak dalej.
- Poboczna liczba kwantowa (l): Określa kształt orbitalu, czyli podpowłokę (l = 0, 1, 2, ..., n-1). Dla l=0 mamy orbital s (sferyczny), dla l=1 mamy orbital p (kształt hantli), dla l=2 mamy orbital d (bardziej złożony kształt), a dla l=3 mamy orbital f (jeszcze bardziej złożony kształt).
- Magnetyczna liczba kwantowa (ml): Określa orientację przestrzenną orbitalu (ml = -l, -l+1, ..., 0, ..., l-1, l). Dla orbitalu s (l=0) mamy tylko jedną orientację (ml=0), dla orbitalu p (l=1) mamy trzy orientacje (ml=-1, 0, 1), dla orbitalu d (l=2) mamy pięć orientacji, a dla orbitalu f (l=3) mamy siedem orientacji.
- Spinowa liczba kwantowa (ms): Określa spin elektronu (ms = +1/2 lub -1/2). Każdy orbital może pomieścić maksymalnie dwa elektrony, które różnią się spinem.
Reguła Pauliego mówi, że w jednym atomie nie mogą istnieć dwa elektrony o identycznym zestawie czterech liczb kwantowych. To oznacza, że każdy orbital może być obsadzony maksymalnie przez dwa elektrony o przeciwnych spinach.
Jak Ustalić Konfigurację Elektronową?
Ustalanie konfiguracji elektronowej sprowadza się do "wypełniania" powłok i podpowłok elektronowych elektronami, zgodnie z kilkoma zasadami:
- Zasada Aufbau (zasada minimalnej energii): Elektrony zajmują najpierw orbitale o najniższej energii. Kolejność zapełniania orbitali można zapamiętać dzięki schematowi energetycznemu (diagramowi Mullikena), który pokazuje, że orbitale 4s zapełniane są przed orbitalami 3d.
- Reguła Hunda: Elektrony zajmują orbitale o tej samej energii (np. orbitale p) pojedynczo, z równoległymi spinami, zanim zaczną je obsadzać parami. Dzieje się tak, ponieważ elektrony o równoległych spinach minimalizują energię atomu.
Przykład: Ustalmy konfigurację elektronową tlenu (O), który ma 8 elektronów.
- Zaczynamy od powłoki n=1, która ma tylko podpowłokę s (1s). Może ona pomieścić 2 elektrony. Zapisujemy: 1s2.
- Następnie przechodzimy do powłoki n=2. Ma ona podpowłoki s (2s) i p (2p). Podpowłoka 2s może pomieścić 2 elektrony. Zapisujemy: 1s2 2s2.
- Do obsadzenia zostaje nam 4 elektrony. Zapełniamy podpowłokę 2p, która może pomieścić 6 elektronów. Zgodnie z regułą Hunda, najpierw umieszczamy po jednym elektronie na każdym z trzech orbitali p, a następnie wracamy i sparowujemy elektrony. Zapisujemy: 1s2 2s2 2p4.
Ostateczna konfiguracja elektronowa tlenu to 1s2 2s2 2p4. Można ją również zapisać skróconą notacją, wykorzystując gaz szlachetny poprzedzający tlen w układzie okresowym (hel, He): [He] 2s2 2p4.
Konfiguracje Walencyjne
Elektrony znajdujące się na zewnętrznej powłoce elektronowej, zwane elektronami walencyjnymi, odgrywają kluczową rolę w tworzeniu wiązań chemicznych. To one decydują o właściwościach chemicznych pierwiastka. Konfiguracja elektronowa walencyjna opisuje rozmieszczenie elektronów tylko na zewnętrznej powłoce. Dla tlenu (O) konfiguracja walencyjna to 2s2 2p4.
Pierwiastki dążą do uzyskania stabilnej konfiguracji elektronowej, czyli takiej, jaką posiadają gazy szlachetne (8 elektronów na zewnętrznej powłoce, z wyjątkiem helu, który ma 2). To dążenie tłumaczy tendencję atomów do oddawania, przyjmowania lub uwspólniania elektronów w celu utworzenia wiązań chemicznych.
Dlaczego Konfiguracja Elektronowa Jest Taka Ważna?
Znajomość konfiguracji elektronowej pozwala na zrozumienie i przewidywanie wielu właściwości pierwiastków i związków chemicznych:
- Aktywność chemiczna: Pierwiastki z niepełnymi powłokami walencyjnymi są bardziej aktywne chemicznie, ponieważ dążą do uzyskania stabilnej konfiguracji elektronowej poprzez tworzenie wiązań.
- Typ wiązań chemicznych: Konfiguracja elektronowa pozwala przewidzieć, czy dany atom będzie tworzył wiązania jonowe (przez oddawanie lub przyjmowanie elektronów) czy kowalencyjne (przez uwspólnianie elektronów).
- Właściwości fizyczne: Konfiguracja elektronowa wpływa na właściwości fizyczne, takie jak przewodnictwo elektryczne, magnetyzm i barwa substancji.
- Reaktywność: Określa z jakimi substancjami dany pierwiastek będzie reagował.
Na przykład, sód (Na) ma konfigurację elektronową [Ne] 3s1. Posiada jeden elektron na zewnętrznej powłoce, który łatwo oddaje, tworząc jon Na+ o stabilnej konfiguracji elektronowej [Ne]. Dlatego sód jest bardzo reaktywnym metalem, który łatwo reaguje z wodą. Z kolei neon (Ne) ma pełną zewnętrzną powłokę elektronową ([He] 2s2 2p6), co czyni go gazem szlachetnym, czyli bardzo niereaktywnym pierwiastkiem.
"Zrozumienie konfiguracji elektronowej to klucz do otwarcia drzwi do fascynującego świata chemii"
Wyjątki od Reguł
Należy pamiętać, że istnieją pewne wyjątki od reguł dotyczących konfiguracji elektronowych. Dotyczy to głównie pierwiastków z bloków d i f, gdzie różnica energii między orbitalami (n-1)d i ns jest niewielka. W niektórych przypadkach, przesunięcie jednego elektronu z orbitalu ns na orbital (n-1)d prowadzi do uzyskania bardziej stabilnej konfiguracji, np. z całkowicie lub częściowo zapełnioną podpowłoką d.
Przykłady:
- Chrom (Cr): Teoretycznie, konfiguracja elektronowa chromu powinna być [Ar] 4s2 3d4. Jednak eksperymentalnie stwierdzono, że rzeczywista konfiguracja to [Ar] 4s1 3d5. Przesunięcie jednego elektronu z 4s na 3d powoduje uzyskanie półpełnej podpowłoki d, co jest energetycznie korzystne.
- Miedź (Cu): Podobnie, miedź powinna mieć konfigurację [Ar] 4s2 3d9, ale w rzeczywistości ma konfigurację [Ar] 4s1 3d10. Przesunięcie elektronu z 4s na 3d daje pełną podpowłokę d, co zwiększa stabilność atomu.
Te wyjątki pokazują, że przewidywanie konfiguracji elektronowych nie zawsze jest proste i wymaga uwzględnienia dodatkowych czynników, takich jak energia wymiany i energia korelacji elektronowej.
Konfiguracja Elektronowa a Układ Okresowy
Układ okresowy pierwiastków został skonstruowany w taki sposób, aby pierwiastki o podobnych właściwościach chemicznych znalazły się w tej samej grupie. To podobieństwo we właściwościach wynika z podobnej konfiguracji elektronowej walencyjnej. Na przykład, wszystkie pierwiastki z pierwszej grupy (metale alkaliczne) mają jeden elektron walencyjny (ns1), co sprawia, że są bardzo reaktywne i łatwo oddają ten elektron, tworząc jony o ładunku +1.
Bloki s, p, d i f w układzie okresowym odpowiadają zapełnianiu się odpowiednich podpowłok elektronowych. Pierwiastki bloku s mają elektrony walencyjne na orbitalach s, pierwiastki bloku p mają elektrony walencyjne na orbitalach p, i tak dalej. Ta korelacja między konfiguracją elektronową a położeniem w układzie okresowym ułatwia przewidywanie właściwości pierwiastków.
Podsumowanie
Zrozumienie konfiguracji elektronowej atomów jest kluczowe dla zrozumienia chemii. Pozwala nam przewidywać właściwości pierwiastków, rodzaj wiązań, jakie będą tworzyć, oraz sposób, w jaki będą reagować z innymi substancjami. Choć ustalanie konfiguracji elektronowej może wydawać się skomplikowane, pamiętając o zasadzie Aufbau, regule Hunda i układzie okresowym, można z powodzeniem przewidywać konfiguracje elektronowe większości pierwiastków. Pamiętajmy jednak o istnieniu wyjątków, które sprawiają, że chemia jest tak fascynującą i nieprzewidywalną nauką. Mam nadzieję, że ten artykuł pomógł Ci zrozumieć, czym jest konfiguracja elektronowa i dlaczego jest tak ważna. Zachęcam do dalszego zgłębiania wiedzy z zakresu chemii! Odkrywanie tajemnic atomów to fascynująca podróż, która pozwala nam lepiej zrozumieć otaczający nas świat.