Co To Jest Dysocjacja Jonowa

Czy kiedykolwiek zastanawiałeś się, dlaczego sól rozpuszcza się w wodzie, a olej nie? Albo dlaczego woda morska przewodzi prąd, a destylowana nie? Odpowiedź leży w zjawisku dysocjacji jonowej. Może to brzmi skomplikowanie, ale obiecuję, że wspólnie to rozłożymy na czynniki pierwsze.
Wiem, że termin "dysocjacja jonowa" może wywoływać nieprzyjemne skojarzenia z lekcjami chemii, które nie zawsze były najprzyjemniejsze. Być może pamiętasz niezrozumiałe wzory i skomplikowane definicje. Ale spróbujmy spojrzeć na to inaczej – nie jako na suchą teorię, ale jako na klucz do zrozumienia wielu zjawisk, które obserwujemy na co dzień. To tak naprawdę fascynująca podróż do świata mikroskopijnych cząsteczek i ich interakcji.
Co to jest dysocjacja jonowa?
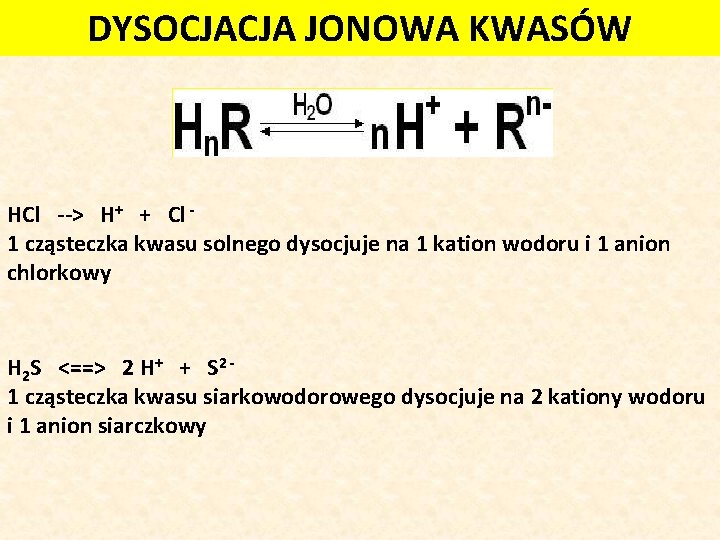
Najprościej mówiąc, dysocjacja jonowa to proces rozpadu związku chemicznego na jony w wyniku działania rozpuszczalnika, najczęściej wody. Ale żeby to naprawdę zrozumieć, musimy rozłożyć to na części:
Co to są jony?
Jony to atomy lub grupy atomów, które posiadają ładunek elektryczny. Mogą być dodatnio naładowane (kationy) – wtedy tracą elektrony, lub ujemnie naładowane (aniony) – wtedy zyskują elektrony. Weźmy na przykład chlorek sodu (NaCl), czyli zwykłą sól kuchenną. Kiedy wrzucimy ją do wody, związek ten rozpada się na jony sodu (Na+) i jony chlorkowe (Cl-).
Jak zachodzi proces dysocjacji?
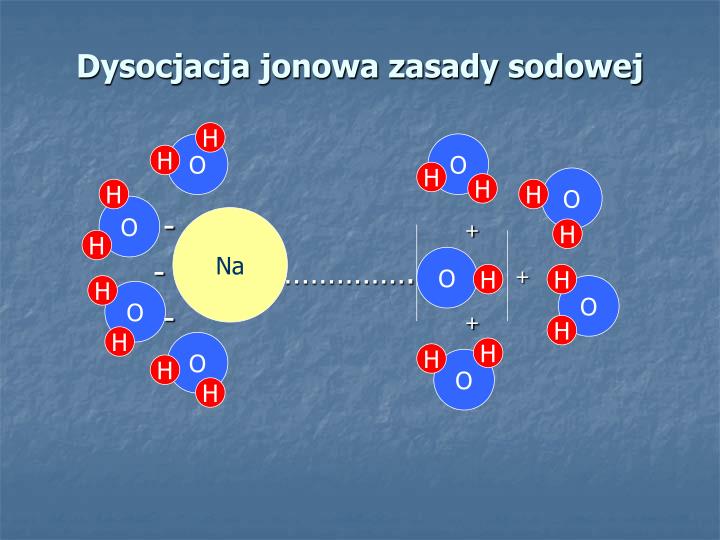
Woda jest cząsteczką polarną, co oznacza, że jeden koniec cząsteczki (tlen) jest lekko ujemny, a drugi (wodory) lekko dodatni. Działa to jak mały magnes. Kiedy kryształ chlorku sodu znajdzie się w wodzie, cząsteczki wody otaczają jony sodu i chlorku. Ujemne końce cząsteczek wody przyciągają jony sodu (Na+), a dodatnie końce przyciągają jony chlorkowe (Cl-). Siła tych przyciągań jest wystarczająco silna, aby pokonać siły wiążące jony w krysztale soli. W rezultacie, kryształ soli rozpada się, a jony sodu i chlorku są rozproszone w wodzie – mówimy, że sól się rozpuściła.
Dlaczego niektóre substancje dysocjują, a inne nie?
Nie wszystkie związki ulegają dysocjacji w wodzie. Decyduje o tym charakter wiązania w danym związku oraz polarność rozpuszczalnika. Związki jonowe (takie jak sól) i związki kowalencyjne polarne (takie jak kwasy) zazwyczaj dobrze dysocjują w wodzie. Związki kowalencyjne niepolarne (takie jak oleje) słabo rozpuszczają się w wodzie i nie dysocjują.
Wyobraź sobie to jako próba rozdzielenia dwóch silnych magnesów. Potrzebujesz naprawdę dużej siły, żeby to zrobić. Cząsteczki wody, dzięki swojej polarności, działają jak ta siła, która rozdziela jony w krysztale soli.
Realny wpływ dysocjacji jonowej
Dysocjacja jonowa nie jest tylko abstrakcyjną teorią. Ma ogromny wpływ na wiele aspektów naszego życia:
- Przewodnictwo elektryczne: Roztwory zawierające jony, takie jak woda z solą, przewodzą prąd elektryczny. Dlatego woda morska jest dobrym przewodnikiem, a woda destylowana, która nie zawiera jonów, nie przewodzi prądu. Jest to fundamentalne dla działania akumulatorów, ogniw paliwowych i wielu innych urządzeń elektrycznych.
- Procesy biologiczne: Dysocjacja jonowa odgrywa kluczową rolę w procesach biologicznych. Jony sodu, potasu, wapnia i chlorku są niezbędne do funkcjonowania nerwów, mięśni i innych tkanek. Utrzymanie odpowiedniego stężenia tych jonów w organizmie jest kluczowe dla zdrowia.
- Reakcje chemiczne: Wiele reakcji chemicznych zachodzi w roztworach wodnych, a dysocjacja jonowa wpływa na szybkość i mechanizm tych reakcji. Na przykład, reakcje kwasowo-zasadowe wymagają obecności jonów wodorowych (H+) i wodorotlenkowych (OH-).
- Oczyszczanie wody: Procesy uzdatniania wody często wykorzystują dysocjację jonową do usuwania zanieczyszczeń. Na przykład, żywice jonowymienne mogą usuwać jony metali ciężkich z wody pitnej.
- Rolnictwo: Nawozy rozpuszczają się w wodzie w glebie, dysocjują na jony i są w ten sposób przyswajane przez rośliny. Zrozumienie procesu dysocjacji jonowej pomaga w optymalnym nawożeniu i poprawie plonów.
Kontrargumenty i spojrzenie z innej strony
Niektórzy mogą argumentować, że skupianie się na dysocjacji jonowej jest zbytnim uproszczeniem. To prawda, że inne czynniki, takie jak siły van der Waalsa i wiązania wodorowe, również odgrywają rolę w rozpuszczalności substancji. Niemniej jednak, dysocjacja jonowa jest fundamentalnym procesem, który wyjaśnia zachowanie wielu związków w roztworach wodnych. Zrozumienie tego procesu jest niezbędne do zrozumienia bardziej złożonych zjawisk chemicznych i biologicznych.
Innym kontrargumentem może być to, że teoria dysocjacji jonowej opiera się na założeniach idealnych roztworów, co w praktyce rzadko się zdarza. W roztworach rzeczywistych występują interakcje między jonami, które wpływają na ich aktywność. Mimo to, teoria dysocjacji jonowej pozostaje cennym narzędziem do przewidywania i interpretacji zachowania roztworów.
Jak wykorzystać wiedzę o dysocjacji jonowej?
Teraz, gdy rozumiesz, czym jest dysocjacja jonowa i jakie ma znaczenie, możesz wykorzystać tę wiedzę w praktyce:
- Eksperymentuj: Spróbuj rozpuścić różne substancje w wodzie i obserwuj, które z nich się rozpuszczają, a które nie. Zastanów się, dlaczego tak się dzieje.
- Analizuj etykiety produktów: Zwróć uwagę na skład produktów, których używasz na co dzień, takich jak napoje, kosmetyki i środki czystości. Spróbuj zidentyfikować związki, które mogą dysocjować w wodzie.
- Ucz się dalej: Pogłębiaj swoją wiedzę o chemii i biologii. Im więcej wiesz, tym lepiej zrozumiesz rolę dysocjacji jonowej w różnych procesach.
Zrozumienie dysocjacji jonowej to pierwszy krok do zrozumienia wielu innych zjawisk chemicznych i biologicznych. Daje Ci to moc lepszego rozumienia świata wokół Ciebie i podejmowania bardziej świadomych decyzji.
Podsumowanie
Dysocjacja jonowa, choć brzmi skomplikowanie, jest procesem rozpadu związku na jony pod wpływem rozpuszczalnika. Ma ogromny wpływ na przewodnictwo elektryczne, procesy biologiczne, reakcje chemiczne, oczyszczanie wody i rolnictwo. Zrozumienie tego zjawiska pozwala nam lepiej rozumieć świat i podejmować bardziej świadome decyzje. Pamiętaj, że wiedza to potęga, a im więcej wiesz, tym bardziej możesz zrozumieć i wpłynąć na świat wokół Ciebie.
Zatem, co zamierzasz zrobić z tą nową wiedzą? Jak wykorzystasz ją w swoim codziennym życiu?


.jpg)