Ciepło Topnienia I Parowania
Każda substancja w naszym otoczeniu istnieje w jednym z trzech podstawowych stanów skupienia: stałym, ciekłym lub gazowym. Przejścia pomiędzy tymi stanami, takie jak topnienie (ze stałego do ciekłego) i parowanie (z ciekłego do gazowego), są procesami termodynamicznymi wymagającymi dostarczenia energii. Energia ta jest nazywana odpowiednio ciepłem topnienia i ciepłem parowania. Zrozumienie tych koncepcji jest fundamentalne dla wielu dziedzin nauki i techniki, od meteorologii po inżynierię materiałową.
Ciepło Topnienia: Pokonywanie Sił Międzycząsteczkowych w Ciele Stałym
Ciepło topnienia, nazywane również entalpią topnienia, to ilość ciepła potrzebna do przekształcenia jednostki masy (np. 1 kg lub 1 mol) substancji ze stanu stałego w stan ciekły w temperaturze topnienia tej substancji. Temperatura topnienia jest charakterystyczna dla danej substancji i zależy od ciśnienia. Podczas topnienia, energia cieplna jest wykorzystywana do pokonania sił międzycząsteczkowych utrzymujących atomy lub cząsteczki w uporządkowanej strukturze kryształu. Temperatura pozostaje stała podczas całego procesu topnienia, ponieważ cała dostarczana energia jest zużywana na zmianę stanu skupienia, a nie na wzrost temperatury.
Mechanizm na poziomie mikroskopowym
W ciele stałym, atomy lub cząsteczki są ściśle upakowane i utrzymywane w stałych pozycjach dzięki silnym wiązaniom międzycząsteczkowym. Dostarczanie ciepła zwiększa energię kinetyczną tych cząsteczek, powodując ich wibracje z coraz większą amplitudą. W temperaturze topnienia, wibracje te są wystarczająco silne, aby pokonać siły wiązań międzycząsteczkowych, umożliwiając cząsteczkom przesunięcie się i przejście do mniej uporządkowanego stanu ciekłego. W stanie ciekłym, cząsteczki nadal oddziałują ze sobą, ale mają większą swobodę ruchu.
Czynniki wpływające na ciepło topnienia
Wielkość ciepła topnienia zależy od:
- Rodzaju substancji: Substancje o silnych wiązaniach międzycząsteczkowych (np. związki jonowe) wymagają większej ilości energii do topnienia niż substancje o słabych wiązaniach (np. gazy szlachetne w stanie stałym).
- Struktury krystalicznej: Różne formy krystaliczne tej samej substancji (polimorfizm) mogą mieć różne temperatury topnienia i ciepła topnienia.
- Ciśnienia: Zmiana ciśnienia może wpływać na temperaturę topnienia, a tym samym na ciepło topnienia, chociaż wpływ ten jest zwykle niewielki.
Przykłady i dane
Dla wody, ciepło topnienia wynosi około 334 kJ/kg (kilodżuli na kilogram). Oznacza to, że potrzeba 334 kJ energii, aby przekształcić 1 kg lodu w wodę o temperaturze 0°C. Dla porównania, ciepło topnienia żelaza jest znacznie wyższe i wynosi około 247 kJ/kg, co odzwierciedla silniejsze wiązania metaliczne w żelazie.
Ciepło Parowania: Zmiana Stanu Ciekłego w Gazowy
Ciepło parowania, nazywane również entalpią parowania, to ilość ciepła potrzebna do przekształcenia jednostki masy substancji ze stanu ciekłego w stan gazowy w temperaturze wrzenia tej substancji. Temperatura wrzenia jest również charakterystyczna dla danej substancji i zależy od ciśnienia. Podczas parowania, energia cieplna jest wykorzystywana do całkowitego pokonania sił międzycząsteczkowych, umożliwiając cząsteczkom oderwanie się od siebie i swobodne poruszanie się w przestrzeni.
Mechanizm na poziomie mikroskopowym
W cieczy, cząsteczki są blisko siebie i oddziałują ze sobą, ale mają pewną swobodę ruchu. Dostarczanie ciepła zwiększa energię kinetyczną cząsteczek, powodując ich szybszy ruch. W temperaturze wrzenia, energia kinetyczna jest wystarczająca, aby pokonać wszystkie siły międzycząsteczkowe, umożliwiając cząsteczkom ucieczkę z powierzchni cieczy i przejście do stanu gazowego. W stanie gazowym, cząsteczki są znacznie bardziej oddalone od siebie i poruszają się swobodnie, z minimalnymi oddziaływaniami międzycząsteczkowymi.
Czynniki wpływające na ciepło parowania
Wielkość ciepła parowania zależy od:
- Rodzaju substancji: Substancje o silnych wiązaniach międzycząsteczkowych (np. woda ze względu na wiązania wodorowe) wymagają większej ilości energii do parowania niż substancje o słabych wiązaniach (np. eter).
- Temperatury: Ciepło parowania maleje wraz ze wzrostem temperatury.
- Ciśnienia: Zmiana ciśnienia wpływa na temperaturę wrzenia, a tym samym na ciepło parowania. Niższe ciśnienie powoduje obniżenie temperatury wrzenia i zmniejszenie ciepła parowania.
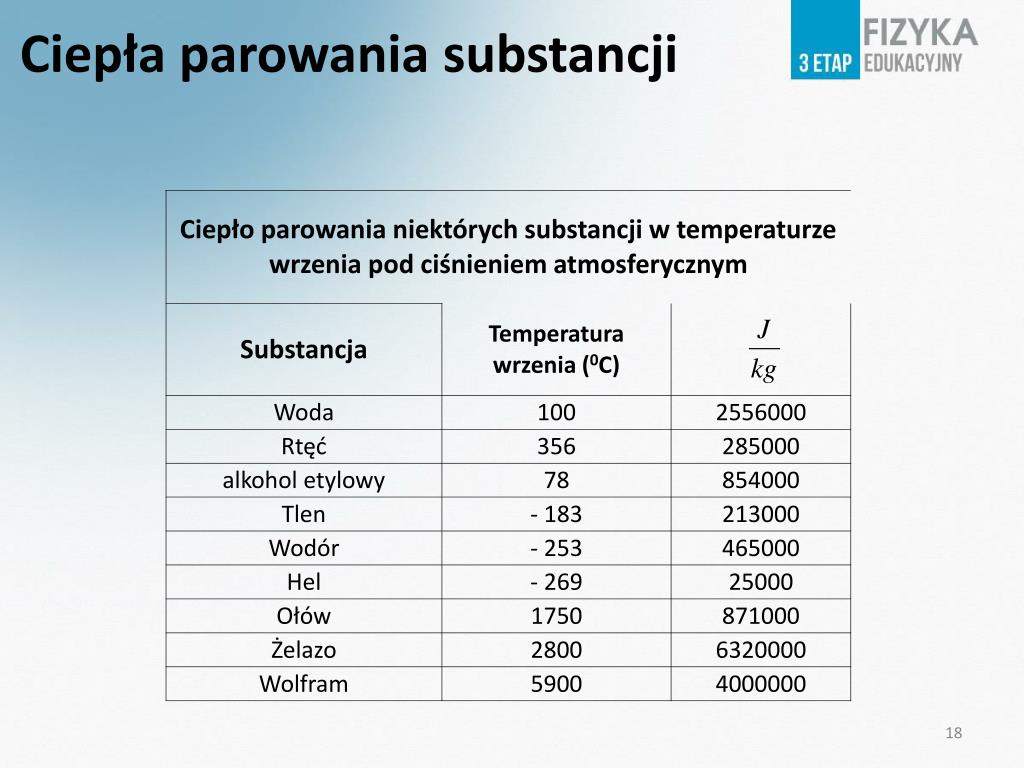
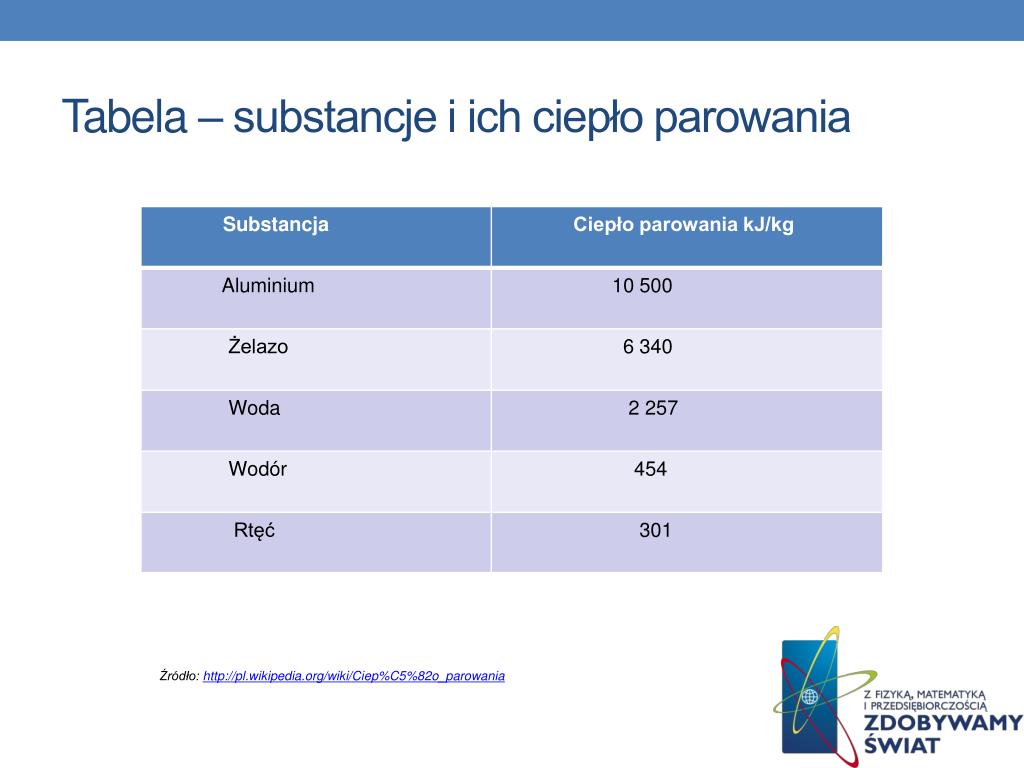
Przykłady i dane
Ciepło parowania wody w temperaturze 100°C wynosi około 2260 kJ/kg. Jest to znacznie więcej niż ciepło topnienia wody, co wskazuje na to, że pokonanie wszystkich sił międzycząsteczkowych w celu przejścia do stanu gazowego wymaga znacznie więcej energii niż tylko osłabienie tych sił w celu przejścia do stanu ciekłego. Dla etanolu, ciepło parowania wynosi około 841 kJ/kg, co jest niższe niż dla wody ze względu na słabsze wiązania wodorowe.
Zastosowania w życiu codziennym i przemyśle
Zrozumienie ciepła topnienia i parowania ma kluczowe znaczenie w wielu zastosowaniach praktycznych:
- Chłodnictwo i klimatyzacja: Czynniki chłodnicze wykorzystują ciepło parowania do absorpcji ciepła z otoczenia i chłodzenia go. Podczas parowania, czynnik chłodniczy pobiera ciepło, obniżając temperaturę wewnątrz lodówki lub klimatyzatora.
- Procesy przemysłowe: W przemyśle chemicznym i farmaceutycznym, ciepło parowania jest wykorzystywane do destylacji, suszenia i innych procesów separacji.
- Meteorologia: Parowanie wody z powierzchni oceanów i lądów odgrywa kluczową rolę w cyklu hydrologicznym i wpływa na klimat. Ciepło parowania absorbowane podczas parowania jest uwalniane podczas kondensacji pary wodnej w chmurach, co napędza burze i inne zjawiska pogodowe.
- Gotowanie: Parowanie wody podczas gotowania jest wykorzystywane do przyrządzania potraw. Para wodna przenosi ciepło do gotowanych produktów, a także pomaga w utrzymaniu odpowiedniej wilgotności.
- Metalurgia: Ciepło topnienia ma kluczowe znaczenie w procesach odlewania, spawania i obróbki cieplnej metali. Znajomość ciepła topnienia pozwala na kontrolowanie temperatury i czasu trwania procesów, co wpływa na właściwości końcowe materiałów.
Podsumowanie
Ciepło topnienia i ciepło parowania to fundamentalne właściwości termodynamiczne materii, które opisują ilość energii potrzebną do zmiany stanu skupienia. Zrozumienie tych koncepcji jest niezbędne w wielu dziedzinach nauki i techniki, od projektowania urządzeń chłodniczych po prognozowanie pogody. Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć te ważne zagadnienia.
Zastanów się: Jakie inne przykłady zastosowania ciepła topnienia i parowania możesz znaleźć w swoim otoczeniu? Jakie dalsze badania mógłbyś przeprowadzić, aby pogłębić swoją wiedzę na ten temat?