Ciekawa Chemia Klasa 7 Budowa Atomu Sprawdzian

Budowa atomu to fundament zrozumienia chemii. To z niej wynikają wszystkie właściwości pierwiastków i związków chemicznych. Sprawdzian z tego zagadnienia w 7 klasie sprawdza, czy rozumiesz podstawowe pojęcia, takie jak protony, neutrony i elektrony.
Cząstki Elementarne Atomu
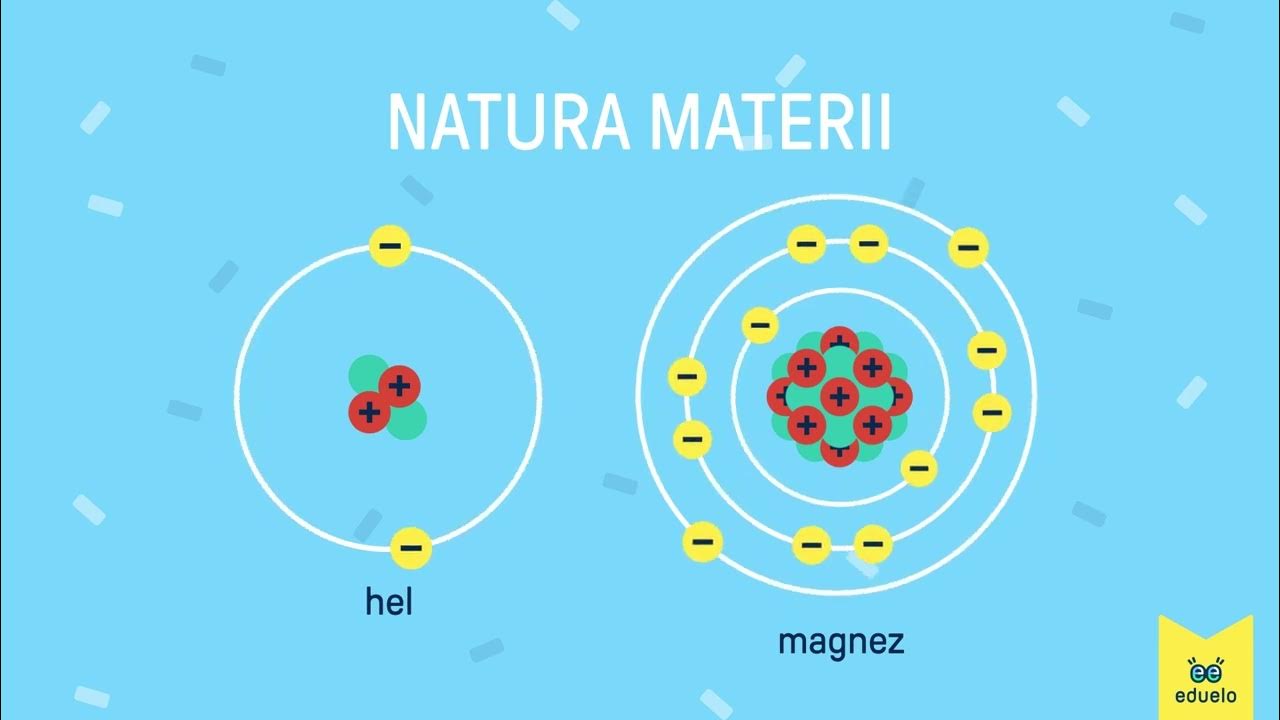
Atom składa się z trzech podstawowych cząstek elementarnych: protonów, neutronów i elektronów.
- Protony (p+): Znajdują się w jądrze atomowym i mają ładunek dodatni (+1). Liczba protonów determinuje, jakim pierwiastkiem jest atom. Na przykład, każdy atom węgla (C) ma 6 protonów. Zmieniając liczbę protonów, zmieniasz pierwiastek!
- Neutrony (n0): Również znajdują się w jądrze atomowym, ale są neutralne (nie mają ładunku). Liczba neutronów wpływa na masę atomu i może powodować istnienie izotopów (atomy tego samego pierwiastka o różnej liczbie neutronów). Na przykład, węgiel może występować jako węgiel-12 (6 neutronów) lub węgiel-14 (8 neutronów).
- Elektrony (e-): Krążą wokół jądra atomowego w tzw. orbitalach. Mają ładunek ujemny (-1). Liczba elektronów w neutralnym atomie jest równa liczbie protonów. Elektrony odpowiadają za właściwości chemiczne atomu – sposób, w jaki łączy się z innymi atomami.
Liczba Atomowa i Liczba Masowa
Aby opisać atom, używamy dwóch ważnych liczb:
- Liczba atomowa (Z): To liczba protonów w jądrze atomowym. Jest to unikalny identyfikator każdego pierwiastka. Na przykład, liczba atomowa tlenu (O) wynosi 8.
- Liczba masowa (A): To suma liczby protonów i neutronów w jądrze atomowym. Przybliża masę atomu. Na przykład, jeśli atom tlenu ma 8 protonów i 8 neutronów, jego liczba masowa wynosi 16.
Możemy zapisać te informacje w formie symbolu: AZX, gdzie X to symbol pierwiastka. Na przykład, 168O to atom tlenu o liczbie masowej 16 i liczbie atomowej 8.
Przykład
Weźmy atom sodu (Na). W układzie okresowym pierwiastków znajdziemy, że jego liczba atomowa (Z) wynosi 11. Oznacza to, że każdy atom sodu ma 11 protonów. Jeśli atom sodu jest neutralny, ma również 11 elektronów. Załóżmy, że atom sodu ma liczbę masową (A) równą 23. Wtedy liczba neutronów wynosi A - Z = 23 - 11 = 12.
Orbitalne i Konfiguracja Elektronowa
Elektrony nie krążą wokół jądra po prostych orbitach, ale zajmują orbitale atomowe o różnych kształtach i energiach. Orbitale tworzą powłoki elektronowe. Pierwsza powłoka (K) może pomieścić maksymalnie 2 elektrony, druga (L) – 8, trzecia (M) – 18, i tak dalej. Sposób rozmieszczenia elektronów na powłokach nazywamy konfiguracją elektronową. Na przykład, konfiguracja elektronowa sodu (Na) to 1s22s22p63s1 (lub krócej 2,8,1).
Znaczenie Praktyczne
Zrozumienie budowy atomu jest kluczowe do zrozumienia, jak działają baterie (przenoszenie elektronów), leki (interakcje między cząsteczkami), i wiele innych aspektów naszego życia. Na przykład, izotopy promieniotwórcze, których istnienie wynika z różnych liczb neutronów w jądrze atomowym, są wykorzystywane w medycynie do diagnozowania i leczenia chorób.