Chrom Tworzy Kilka Różnych Tlenków Charakter Chemiczny

Chrom to taki metal, który lubi się łączyć z tlenem na różne sposoby. W zależności od tego, ile tlenu się do niego "przyczepi", powstają różne związki, czyli tlenki chromu. Każdy z tych tlenków ma też trochę inne "cechy", czyli charakter chemiczny.
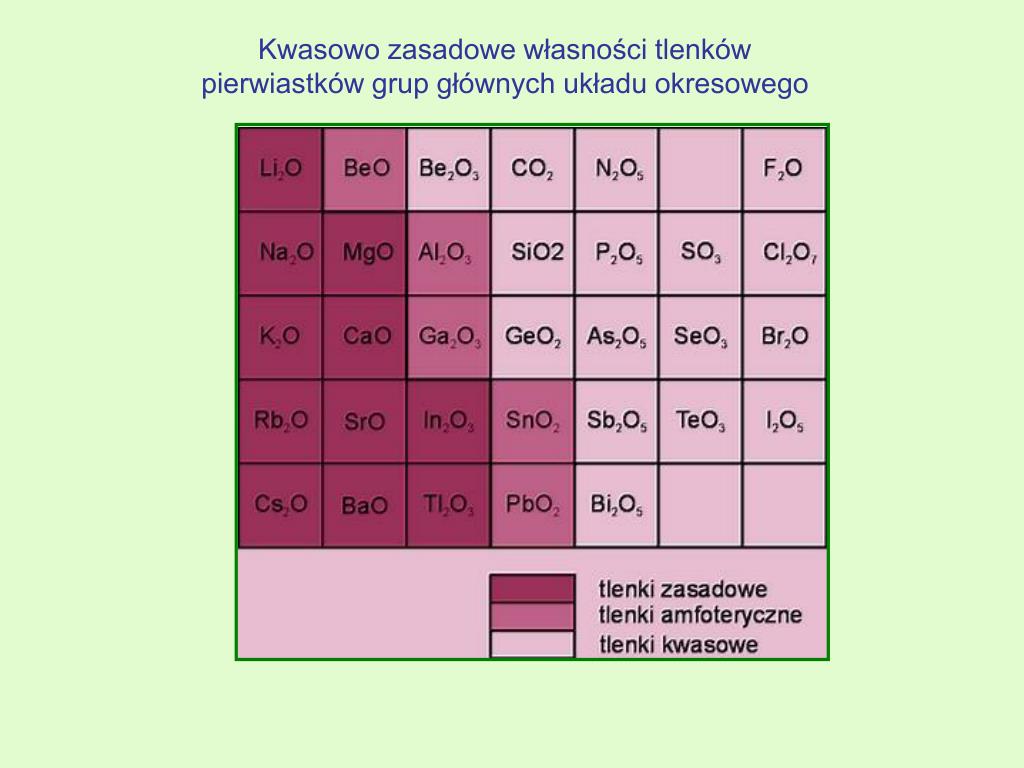
Chrom sam w sobie jest metalem przejściowym, co oznacza, że jest trochę "specjalny" w porównaniu do innych metali. Może tworzyć związki, w których ma różne stopnie utlenienia. Stopień utlenienia to taka "liczba", która mówi nam, ile elektronów atom chromu "oddał" lub "przyjął", kiedy połączył się z innymi atomami. To właśnie te różne stopnie utlenienia pozwalają chromowi tworzyć różne tlenki.
Tlenki Chromu i ich Charakter
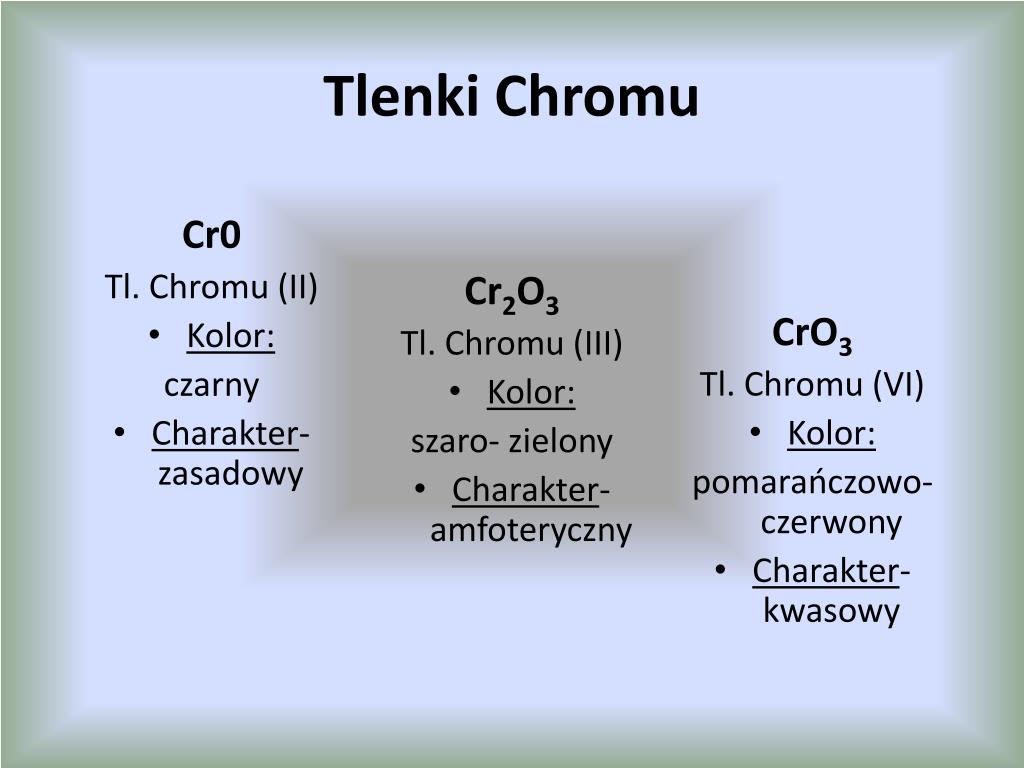
Najbardziej znane tlenki chromu to: tlenek chromu(II) (CrO), tlenek chromu(III) (Cr₂O₃) i tlenek chromu(VI) (CrO₃). Każdy z nich ma inny skład, wygląd i – co najważniejsze – inne właściwości chemiczne.
Tlenek chromu(II) (CrO)
Tlenek chromu(II), czyli CrO, jest czarnym proszkiem. Powstaje, kiedy chrom jest "mniej chętny" do łączenia się z tlenem, czyli na przykład, gdy reakcja zachodzi w słabszych warunkach utleniających. Jest to tlenek o charakterze zasadowym. Co to znaczy? To znaczy, że reaguje z kwasami, tworząc sole chromu(II) i wodę.
Wyobraź sobie, że masz kwas, na przykład kwas solny (HCl). Jeśli wrzucisz do niego tlenek chromu(II), zajdzie reakcja chemiczna. Chrom z tlenku "przejdzie" do roztworu, połączy się z chlorkami z kwasu solnego i powstanie chlorek chromu(II) (CrCl₂), a tlen połączy się z wodorem z kwasu i powstanie woda (H₂O).
To, że CrO reaguje z kwasami, czyni go zasadą w chemicznym sensie. Zasady "lubią" reagować z kwasami, neutralizując je.
Tlenek chromu(III) (Cr₂O₃)
Tlenek chromu(III), czyli Cr₂O₃, jest zielonym proszkiem. Jest bardzo stabilny i odporny na działanie różnych czynników chemicznych. Można go otrzymać na kilka sposobów, na przykład przez spalanie chromu w powietrzu lub rozkład termiczny soli chromu(III).
Charakter tego tlenku jest amfoteryczny. Co to znaczy? To znaczy, że może reagować zarówno z kwasami, jak i z zasadami. To tak, jakby był "dwustronny".
Kiedy Cr₂O₃ reaguje z kwasem, zachowuje się jak zasada. Na przykład, z kwasem siarkowym(VI) (H₂SO₄) powstaje siarczan(VI) chromu(III) (Cr₂(SO₄)₃) i woda.
Z drugiej strony, kiedy Cr₂O₃ reaguje z zasadą, zachowuje się jak kwas. Na przykład, z wodorotlenkiem sodu (NaOH), w wysokiej temperaturze, powstają chromiany(III) sodu (NaCrO₂) i woda. W praktyce reakcja jest bardziej skomplikowana i powstają różne polichromiany.
Amfoteryczność tlenku chromu(III) wynika z tego, że chrom w tym tlenku ma stopień utlenienia +3, który jest "pośredni" między +2 (w CrO) i +6 (w CrO₃). Dzięki temu Cr₂O₃ może "dostosowywać się" do warunków reakcji i reagować albo jak zasada, albo jak kwas.
Tlenek chromu(III) jest szeroko stosowany jako pigment w farbach i ceramice, właśnie ze względu na swoją trwałość i amfoteryczny charakter. Jest też używany jako katalizator w niektórych reakcjach chemicznych.
Tlenek chromu(VI) (CrO₃)
Tlenek chromu(VI), czyli CrO₃, to czerwone kryształy. Jest to bardzo silny utleniacz. Powstaje przez działanie stężonego kwasu siarkowego(VI) na dichromiany. Jest higroskopijny, co oznacza, że łatwo wchłania wilgoć z powietrza.
Charakter CrO₃ jest kwasowy. Oznacza to, że reaguje z zasadami, tworząc sole – chromiany i dichromiany. Na przykład, z wodorotlenkiem sodu (NaOH) powstaje chromian(VI) sodu (Na₂CrO₄) lub, w zależności od warunków, dichromian(VI) sodu (Na₂Cr₂O₇) i woda.
Ponieważ CrO₃ jest silnym utleniaczem, może reagować z wieloma substancjami, utleniając je. Trzeba z nim obchodzić się ostrożnie, bo jest żrący i toksyczny.
Ze względu na swoje właściwości utleniające, CrO₃ jest stosowany w różnych procesach przemysłowych, na przykład do chromowania, czyli pokrywania metali warstwą chromu, która chroni je przed korozją i nadaje im ładny wygląd.
Podsumowując, chrom tworzy różne tlenki, a każdy z nich ma inny charakter chemiczny:
- CrO – zasadowy
- Cr₂O₃ – amfoteryczny
- CrO₃ – kwasowy
Te różnice wynikają z różnych stopni utlenienia chromu w tych tlenkach i mają wpływ na ich właściwości i zastosowania. Zrozumienie tych różnic jest kluczowe dla zrozumienia chemii chromu i jego związków.