Chemia Woda I Roztwory Wodne

Woda. Niezbędna dla życia, wszechobecna i zaskakująco skomplikowana w swojej chemii. Ten artykuł ma na celu przybliżenie tematyki wody i roztworów wodnych osobom bez wykształcenia chemicznego, ale ciekawym świata i chcącym zrozumieć, jak ta niezwykła substancja wpływa na otaczającą nas rzeczywistość. Zrozumiemy, dlaczego woda jest tak dobrym rozpuszczalnikiem, jakie procesy zachodzą, gdy substancje rozpuszczają się w wodzie i jak te roztwory wpływają na nasze codzienne życie.
Czy zastanawiałeś się kiedyś, dlaczego sól rozpuszcza się w wodzie, a olej nie? To właśnie chemia wody i roztworów wodnych kryje w sobie odpowiedź. Odkryjmy razem fascynujący świat molekuł wody, ich interakcji z innymi substancjami i konsekwencji tych interakcji dla naszego środowiska i zdrowia.
Woda: Więcej niż tylko H₂O
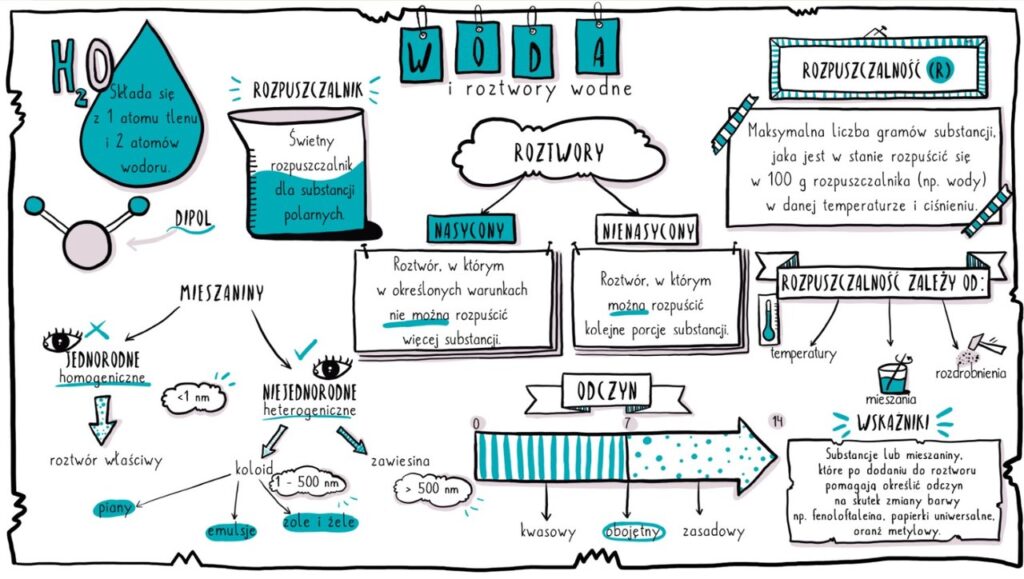
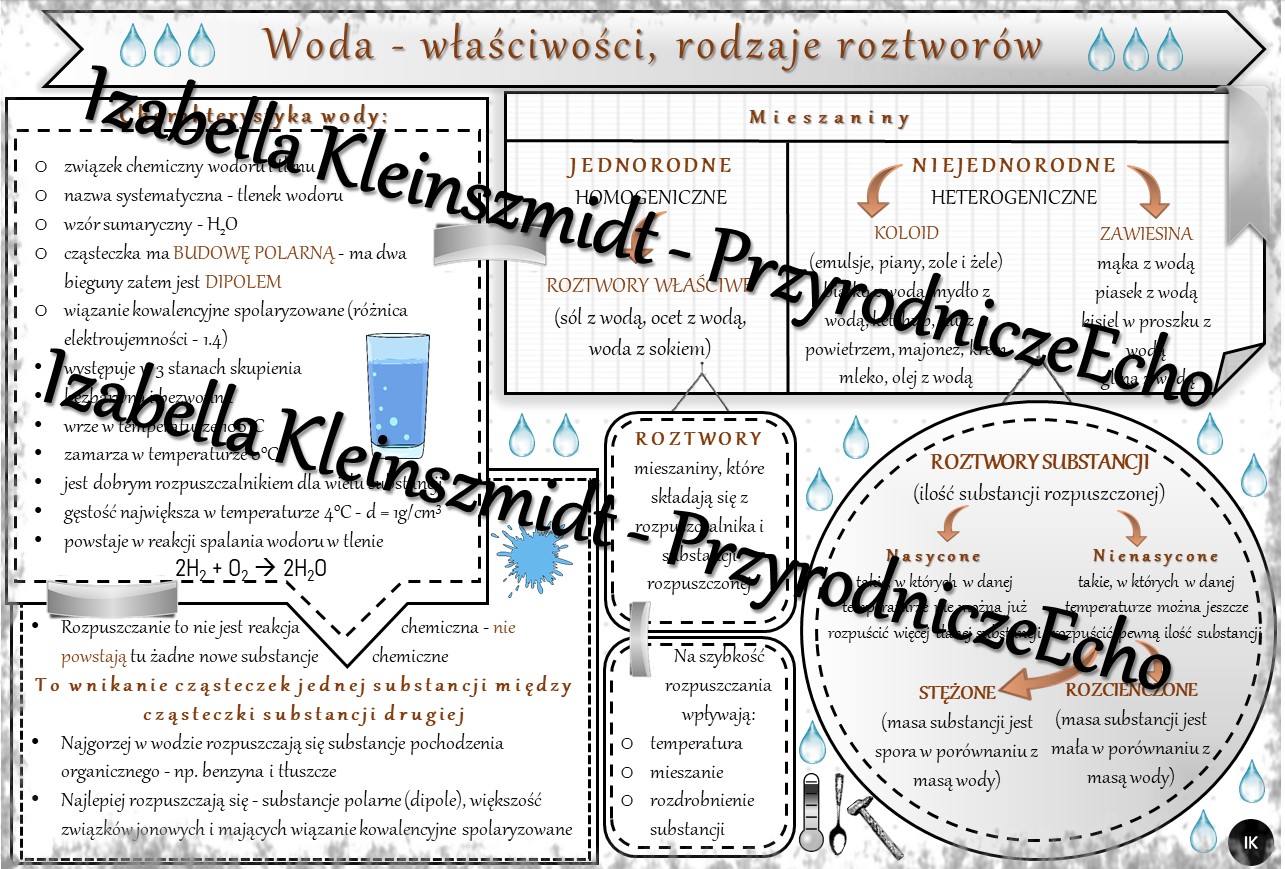
Woda to związek chemiczny o wzorze H₂O, co oznacza, że każda molekuła wody składa się z dwóch atomów wodoru (H) i jednego atomu tlenu (O). Jednak to nie tylko prosta kombinacja atomów. Molekuła wody jest polarna, co oznacza, że posiada nierównomierny rozkład ładunku elektrycznego. Atom tlenu przyciąga elektrony mocniej niż atomy wodoru, co powoduje, że atom tlenu ma niewielki ładunek ujemny (δ-), a atomy wodoru mają niewielki ładunek dodatni (δ+).
Ta polarność wody jest kluczowa dla jej wyjątkowych właściwości. Powoduje, że molekuły wody przyciągają się nawzajem poprzez wiązania wodorowe. Wiązania wodorowe są słabsze niż wiązania kowalencyjne, które łączą atomy wewnątrz molekuły wody, ale są wystarczająco silne, aby wpływać na właściwości fizyczne wody, takie jak wysokie napięcie powierzchniowe, wysokie ciepło właściwe i zdolność do rozpuszczania wielu substancji.
Wiązania wodorowe: Siła spójności wody
Wiązania wodorowe powstają między atomem wodoru z dodatnim ładunkiem w jednej molekule wody, a atomem tlenu z ujemnym ładunkiem w drugiej molekule wody. Te wiązania tworzą sieć, która łączy molekuły wody razem, co nadaje jej wyjątkowe właściwości, takie jak:
- Wysokie napięcie powierzchniowe: To dzięki wiązaniom wodorowym woda tworzy krople i umożliwia owadom chodzenie po jej powierzchni.
- Wysokie ciepło właściwe: Woda potrzebuje dużo energii, aby się ogrzać, co pomaga regulować temperaturę Ziemi i naszych ciał.
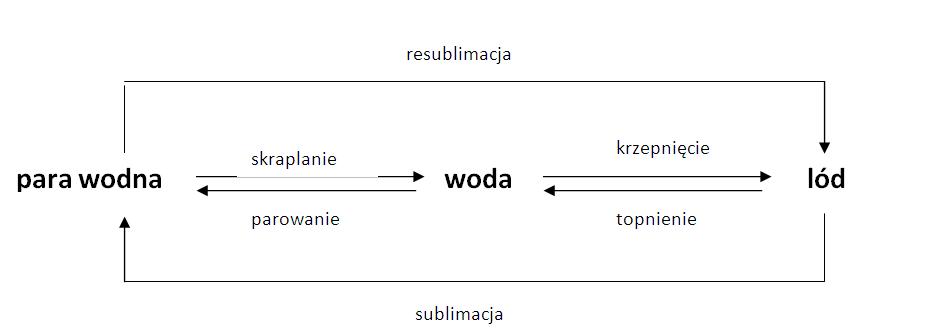
- Gęstość lodu jest mniejsza niż gęstość wody: To pozwala lodowi pływać na wodzie, chroniąc życie wodne w zimie.
- Zdolność do rozpuszczania substancji: To właśnie dzięki polarności i wiązaniom wodorowym woda jest uniwersalnym rozpuszczalnikiem.
Roztwory wodne: Mieszaniny życia
Roztwór wodny to mieszanina, w której woda jest rozpuszczalnikiem, a inna substancja (lub substancje) jest substancją rozpuszczoną. Woda, dzięki swojej polarności, jest doskonałym rozpuszczalnikiem dla substancji polarnych i jonowych. Dzieje się tak, ponieważ molekuły wody mogą otaczać jony lub polarne molekuły substancji rozpuszczonej, osłabiając siły przyciągania między nimi i powodując ich rozproszenie w wodzie.
Kiedy sól kuchenna (NaCl), związek jonowy, rozpuszcza się w wodzie, molekuły wody otaczają jony sodu (Na+) i jony chlorku (Cl-). Ujemnie naładowane atomy tlenu w molekułach wody przyciągają dodatnio naładowane jony sodu, a dodatnio naładowane atomy wodoru w molekułach wody przyciągają ujemnie naładowane jony chlorku. To otoczenie jonów przez molekuły wody nazywa się solwatacją (specjalnie, gdy rozpuszczalnikiem jest woda, nazywa się hydratacją). Hydratacja jonów osłabia siły elektrostatyczne utrzymujące kryształ soli razem, powodując jego rozpad i rozpuszczenie w wodzie.
Rodzaje roztworów wodnych
Roztwory wodne można podzielić na różne kategorie ze względu na stężenie substancji rozpuszczonej:
- Roztwór nienasycony: Roztwór, w którym można rozpuścić więcej substancji rozpuszczonej w danej temperaturze.
- Roztwór nasycony: Roztwór, w którym nie można rozpuścić więcej substancji rozpuszczonej w danej temperaturze. Dodanie więcej substancji rozpuszczonej spowoduje jej osadzenie się na dnie naczynia.
- Roztwór przesycony: Roztwór, który zawiera więcej substancji rozpuszczonej niż jest to możliwe w warunkach równowagi w danej temperaturze. Roztwory przesycone są niestabilne i łatwo ulegają krystalizacji.
Stężenie roztworów wodnych
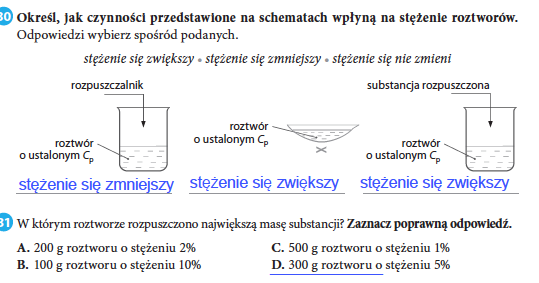
Stężenie roztworu to miara ilości substancji rozpuszczonej w danej objętości roztworu lub masie rozpuszczalnika. Istnieje kilka sposobów wyrażania stężenia roztworów, w tym:
- Stężenie procentowe masowe (% m/m): Wyraża masę substancji rozpuszczonej w 100 gramach roztworu.
- Stężenie procentowe objętościowe (% V/V): Wyraża objętość substancji rozpuszczonej w 100 ml roztworu.
- Stężenie molowe (mol/L): Wyraża liczbę moli substancji rozpuszczonej w 1 litrze roztworu. Jest to jedna z najczęściej używanych jednostek stężenia w chemii.
- Stężenie molalne (mol/kg): Wyraża liczbę moli substancji rozpuszczonej w 1 kilogramie rozpuszczalnika.
Wpływ roztworów wodnych na życie codzienne
Roztwory wodne odgrywają kluczową rolę w wielu aspektach naszego życia codziennego, od procesów biologicznych po przemysł i rolnictwo.
- Procesy biologiczne: Nasze ciała w większości składają się z wody, a większość reakcji biochemicznych zachodzi w roztworach wodnych. Krew, limfa i płyn mózgowo-rdzeniowy to przykłady ważnych roztworów wodnych w naszym organizmie. Transport składników odżywczych, usuwanie odpadów, regulacja temperatury ciała – wszystko to zależy od właściwości roztworów wodnych.
- Gotowanie i przygotowywanie jedzenia: Wiele potraw przygotowujemy przy użyciu roztworów wodnych. Rosół, zupy, sosy, napoje – wszystkie te produkty opierają się na rozpuszczaniu różnych substancji w wodzie. Proces gotowania często polega na zmianie właściwości roztworów wodnych poprzez zmiany temperatury i stężenia.
- Przemysł: Roztwory wodne są szeroko stosowane w przemyśle chemicznym, farmaceutycznym, spożywczym i wielu innych. Są używane jako rozpuszczalniki, reagenty, chłodziwa i w wielu innych zastosowaniach.
- Rolnictwo: Roztwory wodne są niezbędne do nawadniania roślin i nawożenia gleby. Roztwory nawozów dostarczają roślinom niezbędnych składników odżywczych, które są pobierane z gleby przez korzenie.
- Oczyszczanie wody: Proces oczyszczania wody pitnej i ścieków polega na usuwaniu zanieczyszczeń z roztworów wodnych. Różne metody oczyszczania, takie jak filtracja, koagulacja i dezynfekcja, są stosowane w celu uzyskania czystej i bezpiecznej wody.
Wpływ zanieczyszczeń na roztwory wodne
Zanieczyszczenia mogą znacząco wpływać na właściwości roztworów wodnych i stanowić zagrożenie dla zdrowia ludzi i środowiska. Zanieczyszczenia mogą pochodzić z różnych źródeł, takich jak:
- Przemysł: Odpady przemysłowe, takie jak metale ciężkie, substancje toksyczne i pestycydy, mogą zanieczyszczać wody powierzchniowe i podziemne.
- Rolnictwo: Nawozy i pestycydy stosowane w rolnictwie mogą przedostawać się do wód gruntowych i rzek, powodując ich zanieczyszczenie.
- Gospodarstwa domowe: Ścieki z gospodarstw domowych, zawierające detergenty, leki i inne substancje chemiczne, mogą zanieczyszczać wody powierzchniowe.
- Transport: Wycieki ropy naftowej i innych substancji toksycznych podczas transportu mogą zanieczyszczać wody morskie i rzeki.
Zanieczyszczenia mogą wpływać na właściwości fizyczne i chemiczne roztworów wodnych, takie jak pH, twardość, zawartość tlenu i przewodność elektryczna. Mogą również stanowić zagrożenie dla zdrowia ludzi i zwierząt, powodując choroby i zatrucia.
Podsumowanie
Chemia wody i roztworów wodnych to fascynująca i ważna dziedzina nauki, która ma ogromny wpływ na nasze życie. Woda, dzięki swojej wyjątkowej strukturze i właściwościom, jest uniwersalnym rozpuszczalnikiem i odgrywa kluczową rolę w procesach biologicznych, przemyśle, rolnictwie i wielu innych dziedzinach. Zrozumienie chemii wody i roztworów wodnych jest kluczowe dla ochrony zasobów wodnych, zapobiegania zanieczyszczeniom i zapewnienia dostępu do czystej i bezpiecznej wody dla wszystkich. Miejmy świadomość, jak cennym zasobem jest woda i dbajmy o nią na co dzień!
Mam nadzieję, że ten artykuł przybliżył Ci świat chemii wody i roztworów wodnych. Pamiętaj, że wiedza o tym, co nas otacza, pozwala nam podejmować świadome decyzje i dbać o naszą planetę.