Chemia Sprawdzian Woda I Roztwory Wodne Klucz Odpowiedzi Grupa A
Cześć! Wiemy, że Chemia Sprawdzian: Woda i Roztwory Wodne może brzmieć strasznie, ale obiecujemy, że z naszym przewodnikiem wszystko stanie się jasne! Skupimy się na kluczowych zagadnieniach, korzystając z prostych wyjaśnień, porównań i przykładów z życia wziętych, szczególnie przydatnych dla wzrokowców.
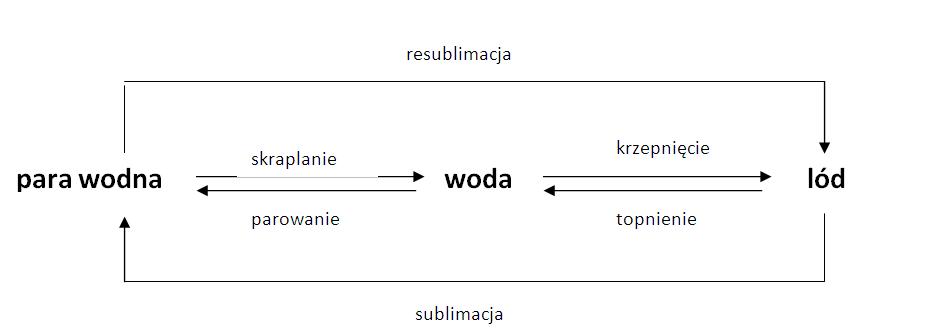
Woda: Więcej niż tylko H2O
Zacznijmy od samej wody, czyli H2O. Wyobraź sobie wodę jako bardzo towarzyską cząsteczkę. Składa się z jednego atomu tlenu (O) i dwóch atomów wodoru (H). Ważne jest, że atomy tlenu i wodoru nie dzielą się elektronami równo. Tlen jest bardziej "chciwy" elektronów, co oznacza, że przyciąga je mocniej niż wodór. To powoduje, że cząsteczka wody ma mały ładunek ujemny (δ-) w pobliżu tlenu i małe ładunki dodatnie (δ+) w pobliżu wodoru. Mówimy, że jest polarna.
Porównanie wizualne: Wyobraź sobie magnes. Ma biegun północny (dodatni) i biegun południowy (ujemny). Cząsteczka wody działa podobnie, chociaż te "bieguny" nie są tak silne jak w magnesie.
Ta polarność sprawia, że woda ma wyjątkowe właściwości. Na przykład, cząsteczki wody przyciągają się nawzajem (dodatni wodór jednej cząsteczki przyciąga ujemny tlen drugiej), tworząc coś, co nazywamy wiązaniami wodorowymi. Te wiązania wodorowe są odpowiedzialne za to, że woda ma wysokie napięcie powierzchniowe (dzięki czemu owady mogą chodzić po wodzie) i wysokie ciepło właściwe (potrzebuje dużo energii, żeby się ogrzać).
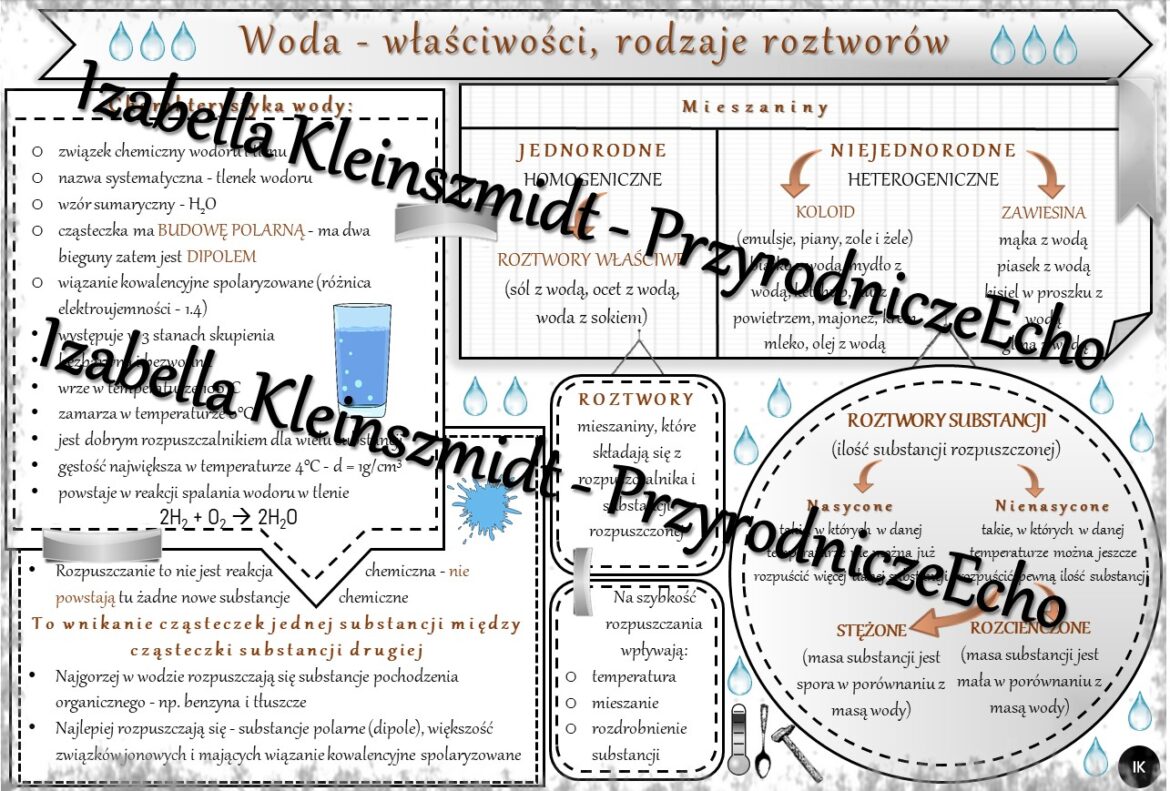
Rozpuszczalność: Co się rozpuszcza, a co nie?
Teraz przejdźmy do rozpuszczalności. Kluczowa zasada brzmi: "Podobne rozpuszcza się w podobnym". Co to znaczy? Oznacza to, że substancje polarne (jak sól) rozpuszczają się w rozpuszczalnikach polarnych (jak woda), a substancje niepolarne (jak olej) rozpuszczają się w rozpuszczalnikach niepolarnych (np. benzyna).
Przykład: Sól kuchenna (NaCl) jest związkiem jonowym, bardzo polarnym. Kiedy wrzucamy ją do wody, cząsteczki wody otaczają jony sodu (Na+) i chloru (Cl-), "wyrywając" je z kryształu soli i rozpraszając je w roztworze. Olej jest niepolarny, więc cząsteczki wody nie są w stanie go otoczyć i rozproszyć – dlatego olej i woda się nie mieszają.
Wizualizacja: Pomyśl o rzepach i velcro. Dwa kawałki velcro łatwo się łączą, ponieważ są "podobne". Natomiast gładka powierzchnia nie będzie się z nimi dobrze łączyć. Podobnie, polarne substancje łączą się z polarnymi rozpuszczalnikami, a niepolarne z niepolarnymi.
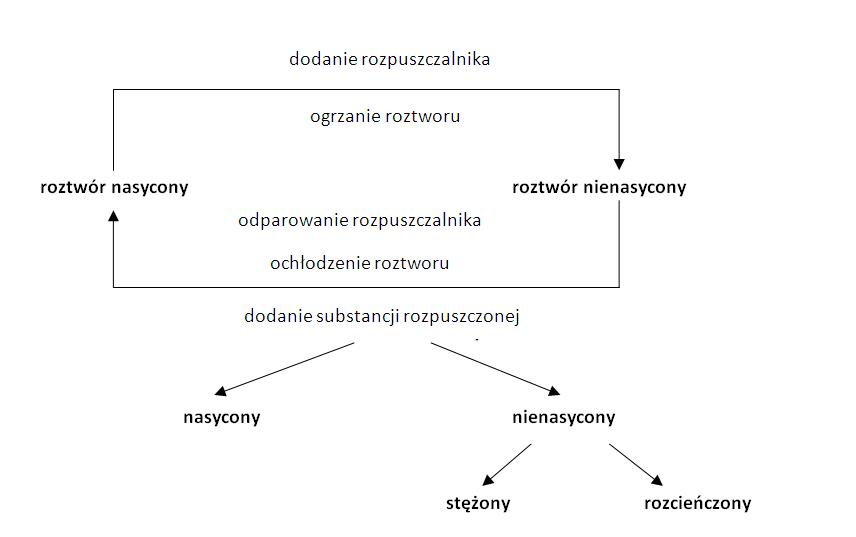
Roztwory Wodne: Składniki i Stężenie
Roztwór to mieszanina dwóch lub więcej substancji, w której jedna substancja (rozpuszczalnik) rozpuszcza drugą (substancję rozpuszczaną). W roztworach wodnych, woda jest zawsze rozpuszczalnikiem.
Przykład: Woda z cukrem. Woda to rozpuszczalnik, a cukier to substancja rozpuszczana. Razem tworzą roztwór.
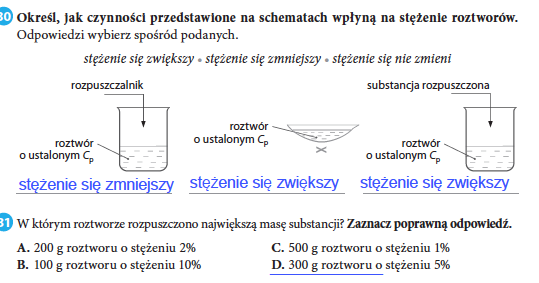
Stężenie Roztworu: Ile czego jest w roztworze?
Stężenie roztworu określa, ile substancji rozpuszczonej znajduje się w danej ilości roztworu. Jest kilka sposobów wyrażania stężenia, ale skupimy się na dwóch najpopularniejszych:
- Stężenie procentowe masowe (Cp): To masa substancji rozpuszczonej w 100 gramach roztworu.
Wzór: Cp = (masa substancji / masa roztworu) * 100%
Przykład: Jeśli mamy 10 gramów soli rozpuszczonych w 90 gramach wody, to masa roztworu wynosi 100 gramów, a stężenie procentowe masowe wynosi (10/100) * 100% = 10%.
- Stężenie molowe (Cm): To liczba moli substancji rozpuszczonej w 1 litrze roztworu.
Wzór: Cm = liczba moli substancji / objętość roztworu (w litrach)
Przykład: Jeśli mamy 1 mol soli rozpuszczony w 1 litrze wody, to stężenie molowe wynosi 1 mol/L (lub 1 M).
Pamiętaj! Przy obliczeniach stężenia ważne jest, aby upewnić się, że jednostki są spójne. Na przykład, masa musi być w gramach, a objętość w litrach lub mililitrach.
Kwasowość i Zasadowość: pH
pH to skala, która mierzy kwasowość lub zasadowość roztworu. Skala pH waha się od 0 do 14. Roztwory o pH poniżej 7 są kwasowe, roztwory o pH powyżej 7 są zasadowe (inaczej alkaliczne), a roztwory o pH równym 7 są obojętne (jak czysta woda).
Wizualizacja: Wyobraź sobie linijkę od 0 do 14. 7 to środek. Im bliżej 0, tym bardziej kwasowy roztwór, im bliżej 14, tym bardziej zasadowy.
Przykłady: Sok z cytryny ma pH około 2 (kwasowy), ocet ma pH około 3 (kwasowy), woda destylowana ma pH 7 (obojętne), a roztwór mydła ma pH około 9 (zasadowy).
Wskazówka: Pamiętaj, że nawet mała zmiana w pH może oznaczać dużą różnicę w kwasowości lub zasadowości. Na przykład, roztwór o pH 3 jest 10 razy bardziej kwasowy niż roztwór o pH 4.
Mamy nadzieję, że ten przewodnik pomógł Ci lepiej zrozumieć zagadnienia dotyczące wody i roztworów wodnych. Pamiętaj o regularnym powtarzaniu materiału, rozwiązywaniu zadań i korzystaniu z różnych źródeł informacji. Powodzenia na sprawdzianie!