Chemia Sprawdzian Sole Klasa 8 Nowa Era
Zbliża się sprawdzian z soli w klasie ósmej? Stresujesz się i nie wiesz, od czego zacząć? Rozumiem doskonale! Chemia, szczególnie dla ósmoklasistów, potrafi być prawdziwym wyzwaniem. Dużo nowych pojęć, reakcji, wzorów – wszystko to naraz może przytłoczyć. Ale spokojnie, ten artykuł jest dla Ciebie. Spróbujemy razem rozszyfrować temat soli, tak aby sprawdzian, zwłaszcza ten z Nowej Ery, nie był już taki straszny.
Celem nie jest tylko wykucie definicji na pamięć. Chcemy zrozumieć, czym są sole, skąd się biorą, jakie mają właściwości i jak je rozpoznać. Co ważniejsze, zobaczymy, gdzie sole "żyją" w naszym codziennym życiu. To pomoże Ci zapamiętać wiadomości na dłużej i przede wszystkim – zastosować wiedzę w praktyce. Bo chemia to nie tylko podręczniki, ale też otaczający nas świat.
Czym właściwie są sole?
Najprościej mówiąc, sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Brzmi skomplikowanie? Spróbujmy inaczej: wyobraź sobie, że masz kwaśny sok z cytryny (kwas) i sodę oczyszczoną (zasada). Kiedy je zmieszasz, zaczyna się burzliwa reakcja, a jednym z produktów jest sól (cytrynian sodu, choć nie tylko!).
Sole powstają w wyniku reakcji neutralizacji, czyli reakcji kwasu z zasadą.
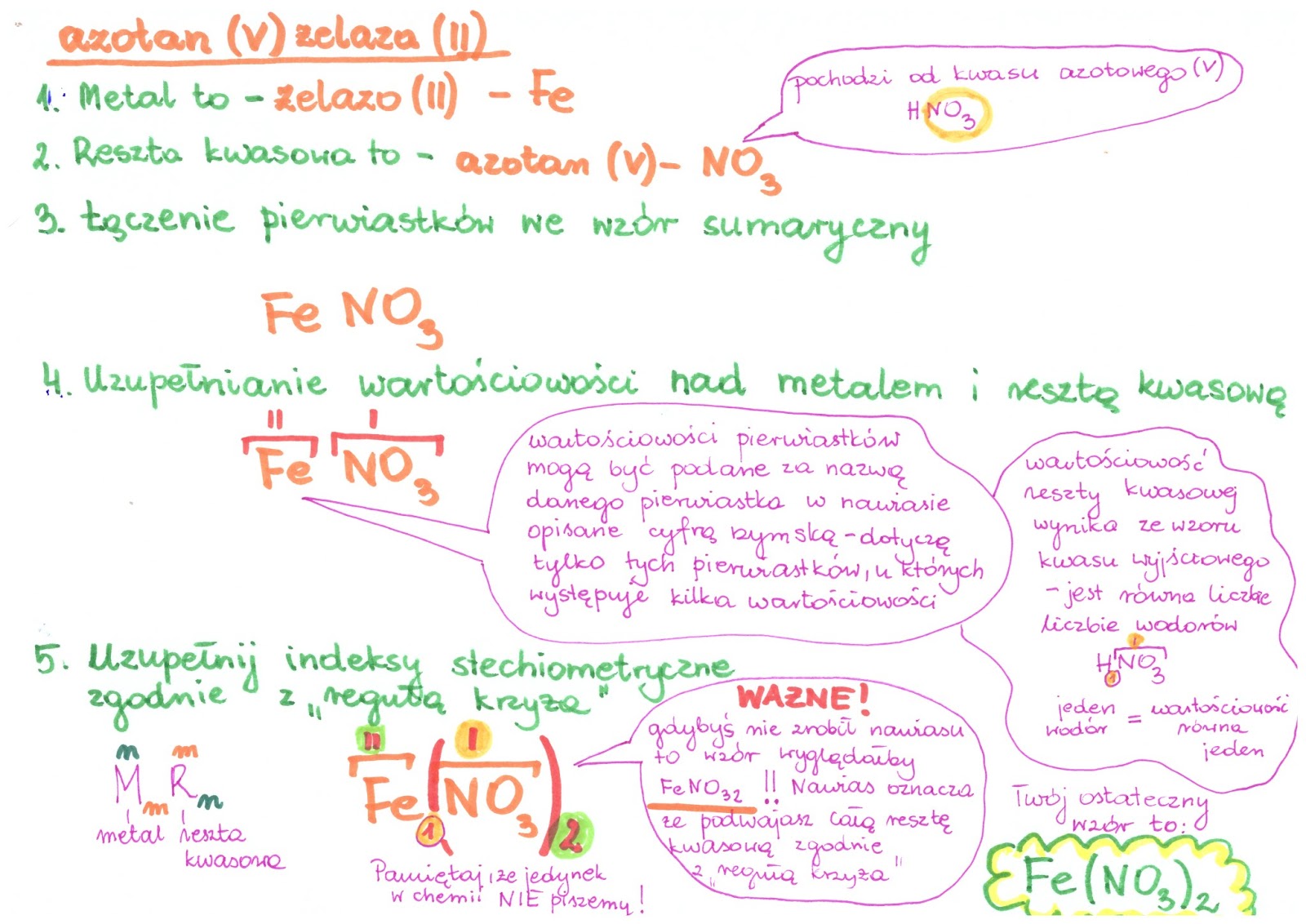
Innymi słowy, sole to związki chemiczne, w których atom metalu (lub grupa amonowa - NH4+) połączony jest z resztą kwasową. Reszta kwasowa to wszystko, co zostaje po odłączeniu atomów wodoru od kwasu. Na przykład, w kwasie siarkowym (H2SO4) resztą kwasową jest SO42-. Dlatego sól siarczan sodu ma wzór Na2SO4.
Nazewnictwo soli – jak się w tym połapać?
Nazwa soli składa się z dwóch części: nazwy reszty kwasowej i nazwy metalu. Na przykład, jeśli mamy kwas chlorowodorowy (HCl) i sód (Na), to powstała sól to chlorek sodu (NaCl).
Jeżeli metal występuje na różnych stopniach utlenienia, należy to zaznaczyć w nazwie soli, używając cyfr rzymskich w nawiasie po nazwie metalu. Na przykład, chlorek żelaza(II) to FeCl2, a chlorek żelaza(III) to FeCl3.
Przykłady:
- Sól kuchenna (chlorek sodu) - NaCl
- Węglan wapnia - CaCO3 (składnik marmuru i wapienia)
- Siarczan miedzi(II) - CuSO4 (stosowany w rolnictwie i ogrodnictwie)
Jak powstają sole? Sposoby otrzymywania
Oprócz wspomnianej już neutralizacji (kwas + zasada), sole można otrzymać na kilka innych sposobów. Warto je znać na sprawdzian:
- Reakcja metalu z kwasem: Metal reaguje z kwasem, tworząc sól i wodór. Na przykład: Zn + 2HCl -> ZnCl2 + H2
- Reakcja tlenku metalu z kwasem: Tlenek metalu reaguje z kwasem, tworząc sól i wodę. Na przykład: CuO + H2SO4 -> CuSO4 + H2O
- Reakcja tlenku niemetalu z zasadą: Tlenek niemetalu reaguje z zasadą, tworząc sól i wodę. Na przykład: CO2 + 2NaOH -> Na2CO3 + H2O
- Reakcja metalu z niemetalem: Niektóre metale reagują bezpośrednio z niemetalami, tworząc sole. Na przykład: 2Na + Cl2 -> 2NaCl
- Reakcja soli z kwasem: Jeżeli powstająca sól jest nierozpuszczalna, to reakcja zajdzie. Na przykład: BaCl2 + H2SO4 -> BaSO4 (osad) + 2HCl
- Reakcja soli z zasadą: Podobnie jak wyżej, jeżeli powstająca sól jest nierozpuszczalna, to reakcja zajdzie. Na przykład: CuSO4 + 2NaOH -> Cu(OH)2 (osad) + Na2SO4
- Reakcja dwóch soli: Jeżeli powstająca sól jest nierozpuszczalna, to reakcja zajdzie. Na przykład: AgNO3 + NaCl -> AgCl (osad) + NaNO3
Zwróć uwagę, że nie wszystkie reakcje prowadzą do powstania soli. Kluczowe jest zrozumienie, jakie związki reagują ze sobą i jakie produkty mogą powstać.
Właściwości soli – co warto zapamiętać?
Sole to związki jonowe, co oznacza, że zbudowane są z jonów o przeciwnych znakach. To wpływa na ich właściwości:
- Stan skupienia: Zazwyczaj są to ciała stałe o budowie krystalicznej.
- Rozpuszczalność: Nie wszystkie sole dobrze rozpuszczają się w wodzie. Tablice rozpuszczalności są bardzo przydatne podczas sprawdzianu. Naucz się z nich korzystać!
- Przewodnictwo elektryczne: Sole w stanie stałym nie przewodzą prądu, ale rozpuszczone w wodzie (roztwory) lub stopione tak.
- Temperatura topnienia: Zazwyczaj wysokie temperatury topnienia.
- Smak: Niektóre sole mają charakterystyczny smak (np. chlorek sodu – słony), ale pamiętaj, że nie wolno próbować substancji chemicznych w laboratorium!
Sole w naszym życiu – gdzie je znajdziemy?
Sole otaczają nas dosłownie wszędzie. Pomyśl o:
- Soli kuchennej (NaCl): Używamy jej do przyprawiania potraw i konserwowania żywności.
- Węglanie wapnia (CaCO3): Składnik kredy, marmuru, wapienia. Stosowany w budownictwie, przemyśle kosmetycznym i farmaceutycznym.
- Siarczanie wapnia (CaSO4): Znany jako gips, używany w budownictwie, medycynie (opatrunki gipsowe).
- Nawozach sztucznych: Zawierają sole azotu, fosforu i potasu, niezbędne do wzrostu roślin.
- Lekach: Wiele leków zawiera sole różnych metali i kwasów.
Zrozumienie, gdzie sole występują i do czego służą, pomoże Ci lepiej zapamiętać ich właściwości i zastosowania.
Sprawdzian z Nowej Ery – czego się spodziewać?
Sprawdziany z Nowej Ery często kładą nacisk na:
- Nazewnictwo soli: Umiejętność poprawnego nazywania soli na podstawie wzoru i odwrotnie.
- Równania reakcji: Zapisywanie i uzgadnianie równań reakcji otrzymywania soli.
- Rozpuszczalność: Korzystanie z tablicy rozpuszczalności do przewidywania, czy dana sól się rozpuści w wodzie.
- Właściwości soli: Znajomość podstawowych właściwości soli i ich wpływu na zastosowania.
- Zastosowania: Wiedza o praktycznym wykorzystaniu różnych soli.
- Obliczenia stechiometryczne: Czasami mogą pojawić się proste zadania obliczeniowe związane z reakcjami soli.
Staraj się rozwiązywać zadania z poprzednich sprawdzianów i testów. To najlepszy sposób, aby sprawdzić swoją wiedzę i przygotować się na to, co może Cię spotkać na sprawdzianie.
Jak efektywnie się uczyć?
Oto kilka wskazówek, które pomogą Ci efektywnie się uczyć do sprawdzianu:
- Zacznij od podstaw: Upewnij się, że rozumiesz, czym są kwasy, zasady i reakcja neutralizacji.
- Stwórz notatki: Zapisuj najważniejsze informacje własnymi słowami.
- Rysuj schematy: Schematycznie przedstawiaj reakcje otrzymywania soli.
- Rozwiązuj zadania: Im więcej zadań rozwiążesz, tym lepiej utrwalisz wiedzę.
- Ucz się z kolegami: Wyjaśnianie zagadnień innym pomaga lepiej zrozumieć je samemu.
- Korzystaj z zasobów online: Internet oferuje wiele materiałów edukacyjnych, filmów i quizów.
- Nie zostawiaj nauki na ostatnią chwilę: Rozplanuj naukę na kilka dni.
Pamiętaj, że regularna nauka i zrozumienie materiału są kluczem do sukcesu. Nie chodzi o wkuwanie definicji na pamięć, ale o zrozumienie, jak działa chemia.
Adresowanie kontrargumentów – czy sole są zawsze szkodliwe?
Często słyszy się, że sole są szkodliwe, np. sól kuchenna w nadmiarze. To prawda, nadmierne spożycie chlorku sodu może prowadzić do problemów zdrowotnych. Jednak nie wszystkie sole są szkodliwe, a wiele z nich jest niezbędnych do życia. Na przykład, sole mineralne są kluczowe dla prawidłowego funkcjonowania organizmu. Poza tym, wiele soli ma cenne zastosowania przemysłowe i rolnicze. Kluczem jest umiar i świadome korzystanie z różnych związków chemicznych.
Podsumowanie i co dalej?
Mamy nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć temat soli i przygotować się do sprawdzianu z chemii. Pamiętaj, że kluczem do sukcesu jest regularna nauka, rozwiązywanie zadań i zrozumienie materiału. Nie bój się pytać nauczyciela o to, czego nie rozumiesz.
Pamiętaj o najważniejszych zagadnieniach: definicja soli, sposoby otrzymywania, właściwości, nazewnictwo i zastosowania. Nowa Era często skupia się na praktycznym wykorzystaniu wiedzy, więc postaraj się znaleźć przykłady zastosowania soli w życiu codziennym.
Życzymy powodzenia na sprawdzianie! Pamiętaj, że stres to naturalna reakcja, ale dobrze przygotowany uczeń jest pewny siebie. Powtórz materiał, zrelaksuj się i pokaż, co potrafisz!
Czy po przeczytaniu tego artykułu czujesz się pewniej, wiedząc, czego możesz się spodziewać na sprawdzianie z soli? Jakie zagadnienie sprawia Ci najwięcej trudności?