Chemia Sprawdzian Sole 2 Gimnazjum Tabela Soli

Sprawdziany z chemii, a w szczególności te dotyczące soli w drugiej klasie gimnazjum, często sprawiają uczniom trudności. Zrozumienie tematu soli jest kluczowe do dalszej nauki chemii, dlatego solidne przygotowanie jest niezwykle istotne. W tym artykule omówimy kluczowe aspekty związane z solami, w tym tabelę rozpuszczalności soli, wzory chemiczne, nazewnictwo oraz przykłady reakcji chemicznych, w których sole biorą udział.
Kluczowe zagadnienia dotyczące soli
Czym są sole?
Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Dokładniej, są to związki jonowe zbudowane z kationu (jonu o ładunku dodatnim, zwykle metalu lub amonu NH4+) i anionu (jonu o ładunku ujemnym, pochodzącego od kwasu). Ogólny wzór soli to MxAy, gdzie M to metal, A to reszta kwasowa, a x i y to współczynniki stechiometryczne.
Przykłady soli: NaCl (chlorek sodu - sól kuchenna), CaSO4 (siarczan(VI) wapnia), KNO3 (azotan(V) potasu).
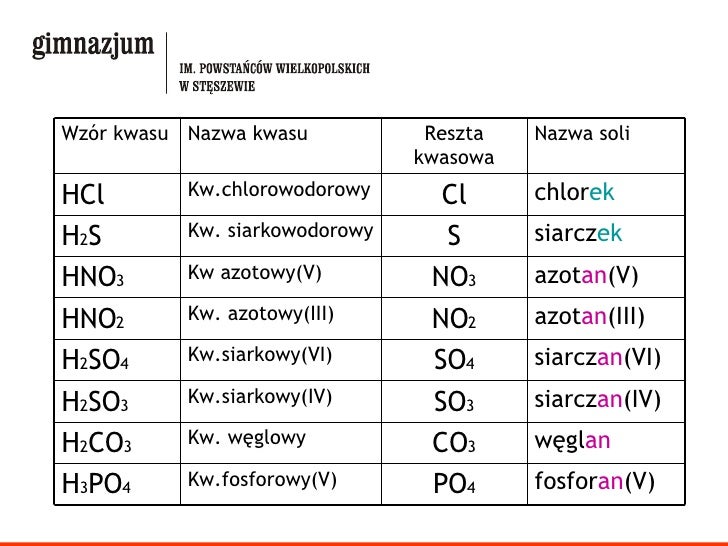
Nazewnictwo soli
Nazwa soli składa się z dwóch części: nazwy anionu (pochodzącej od kwasu) i nazwy kationu (pochodzącej od metalu). Należy również uwzględnić wartościowość metalu, jeśli dany metal występuje na różnych stopniach utlenienia. Wtedy po nazwie metalu w nawiasie podaje się jego wartościowość cyframi rzymskimi.
Przykłady:
- NaCl - chlorek sodu (sód jest zawsze jednowartościowy)
- FeCl2 - chlorek żelaza(II) (żelazo występuje na II stopniu utlenienia)
- FeCl3 - chlorek żelaza(III) (żelazo występuje na III stopniu utlenienia)
- CuSO4 - siarczan(VI) miedzi(II)
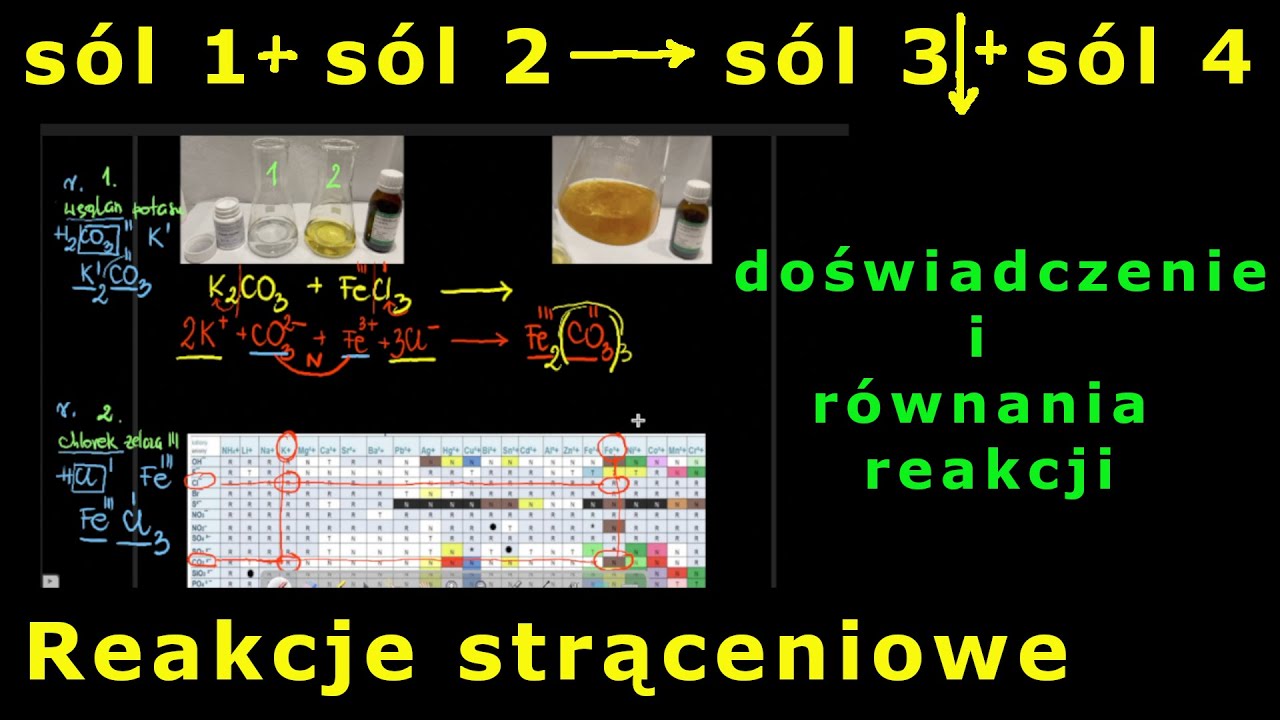
Rozpuszczalność soli w wodzie - Tabela rozpuszczalności
Rozpuszczalność soli to zdolność soli do rozpuszczania się w wodzie. Nie wszystkie sole rozpuszczają się w wodzie w takim samym stopniu. Niektóre są bardzo dobrze rozpuszczalne, inne słabo, a jeszcze inne w ogóle się nie rozpuszczają. Do określania rozpuszczalności soli służy tabela rozpuszczalności soli. Jest to niezbędne narzędzie przy rozwiązywaniu zadań z chemii, szczególnie tych związanych z reakcjami strąceniowymi.
Tabela rozpuszczalności soli zawiera informacje na temat rozpuszczalności poszczególnych soli w wodzie. Oznaczenia w tabeli zwykle wyglądają następująco:
- R - sól rozpuszczalna
- N - sól nierozpuszczalna
- S - sól trudno rozpuszczalna
- H - sól hydrolizuje (ulega reakcji z wodą)
Korzystanie z tabeli jest proste. W pierwszej kolumnie zwykle znajdują się kationy (metale), a w pierwszym wierszu aniony (reszty kwasowe). Aby sprawdzić rozpuszczalność danej soli, należy znaleźć w tabeli odpowiednie przecięcie wiersza i kolumny.
Reakcje z udziałem soli
Sole biorą udział w wielu reakcjach chemicznych, m.in.:
- Reakcje strąceniowe: Reakcje, w których powstaje nierozpuszczalna sól (osad). Przykładowo:
- Reakcje z kwasami: Niektóre sole reagują z kwasami, wydzielając gaz lub tworząc nową sól. Przykładowo:
- Reakcje z zasadami: Niektóre sole reagują z zasadami, tworząc wodorotlenek lub inną sól.
- Reakcje wymiany: Reakcje, w których wymieniają się kationy i aniony między dwiema solami.
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
Chlorek srebra (AgCl) jest nierozpuszczalny i wytrąca się w postaci białego osadu.
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
Węglan wapnia (CaCO3) reaguje z kwasem solnym (HCl), wydzielając dwutlenek węgla (CO2).
Przykłady soli w życiu codziennym
- Chlorek sodu (NaCl) – sól kuchenna, niezbędna do życia, stosowana w kuchni, konserwacji żywności i przemyśle chemicznym.
- Węglan wapnia (CaCO3) – składnik wapienia, marmuru i kredy. Stosowany w budownictwie, przemyśle cementowym i rolnictwie.
- Siarczan(VI) wapnia (CaSO4) – gips, stosowany w budownictwie, medycynie (gipsowe opatrunki) i sztuce.
- Azotan(V) potasu (KNO3) – saletra potasowa, stosowany jako nawóz sztuczny i w produkcji prochu strzelniczego.
- Wodorowęglan sodu (NaHCO3) – soda oczyszczona, stosowana w kuchni, medycynie i kosmetyce.
Podsumowanie
Temat soli w chemii, choć na pierwszy rzut oka może wydawać się trudny, jest w rzeczywistości bardzo logiczny i opiera się na prostych zasadach. Kluczowe jest zrozumienie definicji soli, poprawne nazewnictwo, umiejętność korzystania z tabeli rozpuszczalności oraz znajomość typowych reakcji chemicznych, w których sole biorą udział. Solidne przygotowanie z tego zakresu pozwoli na łatwiejsze zrozumienie bardziej zaawansowanych zagadnień chemicznych w przyszłości.
Aby dobrze przygotować się do sprawdzianu, warto:
- Powtórzyć definicje i zasady nazewnictwa soli.
- Przećwiczyć rozwiązywanie zadań z wykorzystaniem tabeli rozpuszczalności.
- Przeprowadzić proste doświadczenia chemiczne z solami (oczywiście pod nadzorem osoby dorosłej).
- Rozwiązać zadania z poprzednich sprawdzianów.
Powodzenia na sprawdzianie!