Chemia Nowej Ery 2 Sprawdzian Wodorotlenki
Wodorotlenki są kluczową grupą związków chemicznych, odgrywających istotną rolę w wielu procesach przemysłowych, biologicznych i środowiskowych. Rozumienie ich właściwości i reakcji jest fundamentalne dla każdego ucznia chemii, a sprawdziany, takie jak te z serii Chemia Nowej Ery 2, stanowią ważny element oceny tej wiedzy. Ten artykuł ma na celu przybliżenie najważniejszych zagadnień związanych z wodorotlenkami, które mogą pojawić się na sprawdzianie, wyjaśniając je w sposób klarowny i szczegółowy.
Definicja i budowa wodorotlenków
Wodorotlenki to związki chemiczne, które zawierają grupę hydroksylową (-OH) połączoną z atomem metalu (wodorotlenki metali) lub grupą organiczną (np. alkohole). W przypadku wodorotlenków metali, wiązanie między metalem a grupą hydroksylową jest jonowe. To właśnie obecność grupy hydroksylowej determinuje charakterystyczne właściwości tych związków.
Dysocjacja elektrolityczna wodorotlenków
Wodorotlenki metali, rozpuszczone w wodzie, ulegają dysocjacji elektrolitycznej, co oznacza, że rozpadają się na jony. Proces ten można zapisać ogólnym równaniem:
MOH → M+ + OH-
Gdzie M symbolizuje metal, a OH- to jon wodorotlenkowy. Obecność jonów OH- w roztworze powoduje, że roztwór staje się zasadowy.
Siła wodorotlenku zależy od stopnia jego dysocjacji. Mocne wodorotlenki (np. NaOH, KOH) dysocjują całkowicie, uwalniając dużą liczbę jonów OH-, podczas gdy słabe wodorotlenki (np. Cu(OH)2, Fe(OH)3) dysocjują tylko częściowo. Właśnie stopień dysocjacji wodorotlenków wpływa na ich zdolność do neutralizacji kwasów i inne reakcje chemiczne.
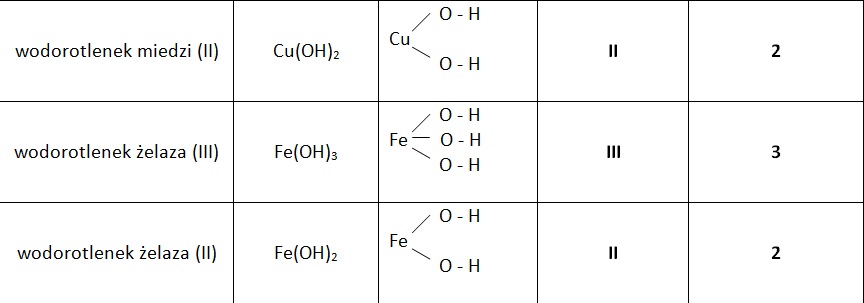
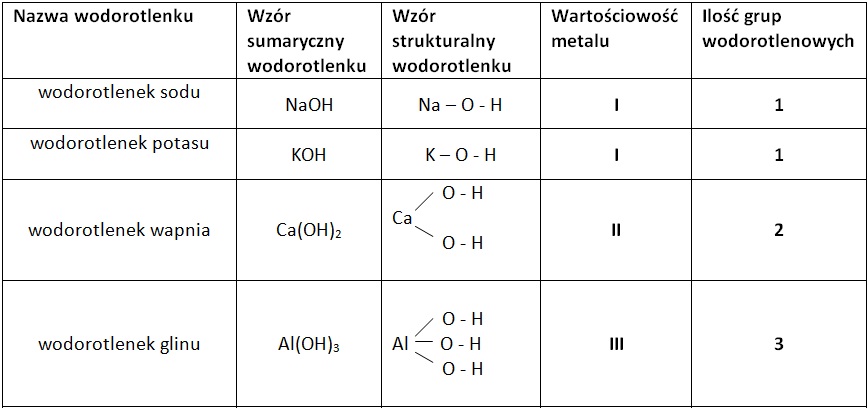
Nazewnictwo wodorotlenków
Nazewnictwo wodorotlenków jest stosunkowo proste. Nazwa składa się z dwóch członów: słowa "wodorotlenek" oraz nazwy metalu (lub grupy organicznej), z którym grupa hydroksylowa jest połączona. Jeżeli metal występuje na różnych stopniach utlenienia, należy podać w nawiasie wartościowość metalu cyframi rzymskimi. Przykłady:
- NaOH - Wodorotlenek sodu
- KOH - Wodorotlenek potasu
- Ca(OH)2 - Wodorotlenek wapnia
- Fe(OH)2 - Wodorotlenek żelaza(II)
- Fe(OH)3 - Wodorotlenek żelaza(III)
Zapamiętanie reguł nazewnictwa jest kluczowe do poprawnego zapisywania wzorów i nazw wodorotlenków podczas sprawdzianu.
Właściwości fizyczne i chemiczne wodorotlenków
Właściwości fizyczne
Wodorotlenki metali alkalicznych (grupa 1 układu okresowego) to zazwyczaj białe, higroskopijne ciała stałe, dobrze rozpuszczalne w wodzie. Wodorotlenki metali alkalicznych ziemi (grupa 2 układu okresowego) są również ciałami stałymi, ale ich rozpuszczalność w wodzie jest zazwyczaj niższa. Wodorotlenki metali przejściowych są na ogół nierozpuszczalne w wodzie i tworzą osady o charakterystycznych barwach. Przykładowo, wodorotlenek miedzi(II) (Cu(OH)2) ma barwę niebieską, a wodorotlenek żelaza(III) (Fe(OH)3) ma barwę rdzawą.
Właściwości chemiczne
Do najważniejszych właściwości chemicznych wodorotlenków należą:
- Reakcje zobojętniania: Wodorotlenki reagują z kwasami, tworząc sól i wodę. Jest to reakcja neutralizacji. Równanie ogólne: Kwas + Wodorotlenek → Sól + Woda Przykład: HCl + NaOH → NaCl + H2O
- Reakcje z tlenkami kwasowymi: Wodorotlenki reagują z tlenkami kwasowymi, tworząc sól i (czasami) wodę. Przykład: 2NaOH + CO2 → Na2CO3 + H2O
- Reakcje z solami: Wodorotlenki mogą reagować z solami, tworząc nowy wodorotlenek i nową sól, o ile przynajmniej jeden z produktów jest nierozpuszczalny (reakcja strąceniowa). Przykład: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
- Działanie na wskaźniki: Wodorotlenki zmieniają barwę wskaźników kwasowo-zasadowych. Przykładowo, fenoloftaleina w roztworach wodorotlenków przyjmuje barwę malinową, a uniwersalny papierek wskaźnikowy staje się niebieski lub granatowy.
Otrzymywanie wodorotlenków
Wodorotlenki można otrzymywać różnymi metodami. Najczęściej stosowane to:
- Reakcja aktywnego metalu z wodą: Metale alkaliczne i alkaliczne ziemie reagują z wodą, tworząc wodorotlenek i wodór. Przykład: 2Na + 2H2O → 2NaOH + H2↑
- Reakcja tlenku metalu z wodą: Tlenki metali alkalicznych i alkalicznych ziem ziemie reagują z wodą, tworząc wodorotlenek. Przykład: CaO + H2O → Ca(OH)2
- Reakcja soli z wodorotlenkiem (reakcja strąceniowa): Jeśli w wyniku reakcji powstaje nierozpuszczalny wodorotlenek, reakcja zachodzi. Przykład: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
- Elektroliza roztworów chlorków metali alkalicznych: Metoda stosowana do przemysłowej produkcji wodorotlenku sodu (NaOH).
Znaczenie wodorotlenków w życiu codziennym i przemyśle
Wodorotlenki znajdują szerokie zastosowanie w różnych dziedzinach życia i przemyśle. Przykłady:
- Wodorotlenek sodu (NaOH): Używany do produkcji mydeł, detergentów, papieru, aluminium, a także w przemyśle włókienniczym i chemicznym. Jest również stosowany do udrażniania rur kanalizacyjnych.
- Wodorotlenek potasu (KOH): Stosowany w produkcji mydeł potasowych (mydła w płynie), nawozów, akumulatorów alkalicznych.
- Wodorotlenek wapnia (Ca(OH)2): Znany jako wapno gaszone. Używany w budownictwie (jako składnik zapraw murarskich i tynkarskich), rolnictwie (do odkwaszania gleby), przemyśle spożywczym (do produkcji cukru).
- Wodorotlenek magnezu (Mg(OH)2): Stosowany jako lek zobojętniający kwas żołądkowy (antacid), a także jako dodatek do past do zębów i kosmetyków.
- Wodorotlenek glinu (Al(OH)3): Stosowany w produkcji adsorbentów, środków przeciwpotnych, leków zobojętniających kwas żołądkowy.
Przemysłowe dane dotyczące produkcji wodorotlenków, takie jak globalna produkcja NaOH, wynosząca kilkadziesiąt milionów ton rocznie, świadczą o ogromnym znaczeniu tych związków dla gospodarki światowej.
Przykładowe zadania sprawdzianowe i wskazówki
Na sprawdzianie z chemii, takim jak Chemia Nowej Ery 2 Sprawdzian Wodorotlenki, możesz spodziewać się zadań dotyczących:
- Nazewnictwa i wzorów wodorotlenków: Należy umieć poprawnie zapisywać wzory sumaryczne i nazwy wodorotlenków.
- Równań reakcji: Należy umieć pisać i bilansować równania reakcji wodorotlenków z kwasami, tlenkami kwasowymi i solami.
- Obliczania pH roztworów wodorotlenków: Znając stężenie jonów OH-, należy umieć obliczyć pH roztworu.
- Rozpoznawania wodorotlenków: Na podstawie obserwacji (np. barwy osadu) należy umieć zidentyfikować dany wodorotlenek.
- Zastosowań wodorotlenków: Należy znać przykłady zastosowań wodorotlenków w różnych dziedzinach.
Wskazówki:
- Upewnij się, że dobrze znasz zasady nazewnictwa związków chemicznych.
- Pamiętaj o bilansowaniu równań reakcji.
- Zwróć uwagę na rozpuszczalność wodorotlenków w wodzie, ponieważ ma to wpływ na przebieg reakcji.
- Przeprowadź w myślach proste doświadczenia chemiczne z wodorotlenkami, aby lepiej zrozumieć ich właściwości.
Podsumowanie
Wodorotlenki stanowią istotną grupę związków chemicznych o szerokim spektrum zastosowań. Zrozumienie ich budowy, właściwości i reakcji jest niezbędne dla każdego ucznia chemii. Przygotowując się do sprawdzianu z wodorotlenków, takiego jak Chemia Nowej Ery 2 Sprawdzian Wodorotlenki, warto skupić się na opanowaniu zasad nazewnictwa, pisania równań reakcji oraz znajomości praktycznych zastosowań tych związków. Pamiętaj, że solidna wiedza teoretyczna, połączona z umiejętnością rozwiązywania zadań, to klucz do sukcesu.
Powodzenia na sprawdzianie! Gruntowne przygotowanie i systematyczna nauka to najlepsza droga do osiągnięcia sukcesu.