Chemia Kwasy Sprawdzian 2 Gimnazjum Grupa Cid

Zapewne przygotowujesz się do sprawdzianu z chemii, a konkretnie z kwasów w drugiej klasie gimnazjum. Grupa Cid... brzmi tajemniczo, ale tak naprawdę chodzi o zrozumienie podstawowych właściwości i reakcji kwasów. Zamiast stresować się, potraktujmy to jako wyzwanie! Poniżej znajdziesz praktyczne informacje i przykłady, które pomogą Ci zdać ten sprawdzian bez problemu.
Czym są kwasy?
Najprościej mówiąc, kwasy to substancje chemiczne, które:
- Mają kwaśny smak (ale nigdy nie próbuj kwasów laboratoryjnych!).
- Powodują zmianę barwy wskaźników (np. oranż metylowy staje się czerwony, a lakmus – czerwony).
- Reagują z metalami, tworząc sole i wodór (nie wszystkie metale reagują z wszystkimi kwasami).
- Reagują z zasadami, tworząc sole i wodę (reakcja neutralizacji).
Gdzie spotykamy kwasy w życiu codziennym?
- Kwas octowy (CH3COOH) – ocet kuchenny.
- Kwas cytrynowy (C6H8O7) – w cytrynach i innych owocach cytrusowych.
- Kwas solny (HCl) – w żołądku, pomaga trawić pokarm.
- Kwas węglowy (H2CO3) – w napojach gazowanych.
Jak pisać wzory i nazwy kwasów?
To klucz do sukcesu na sprawdzianie. Pamiętaj, że kwasy dzielimy na tlenowe i beztlenowe.
Kwasy beztlenowe
- Składają się z wodoru i niemetalu.
- Nazwa tworzona jest od nazwy niemetalu z dodaniem przedrostka "kwas" i przyrostka "-owodorowy".
- Przykłady:
- HCl – kwas chlorowodorowy
- HBr – kwas bromowodorowy
- HF – kwas fluorowodorowy
- H2S – kwas siarkowodorowy
Kwasy tlenowe
- Składają się z wodoru, niemetalu i tlenu.
- Nazwa tworzona jest od nazwy niemetalu z dodaniem przedrostka "kwas" i odpowiedniego przyrostka, zależnie od stopnia utlenienia niemetalu:
- -owy (dla wyższych stopni utlenienia, np. siarka w kwasie siarkowym(VI))
- -awy (dla niższych stopni utlenienia, np. siarka w kwasie siarkowym(IV))
- Przykłady:
- H2SO4 – kwas siarkowy(VI) (popularnie zwany kwasem siarkowym)
- H2SO3 – kwas siarkowy(IV) (kwas siarkowy)
- HNO3 – kwas azotowy(V) (kwas azotowy)
- HNO2 – kwas azotowy(III) (kwas azotawy)
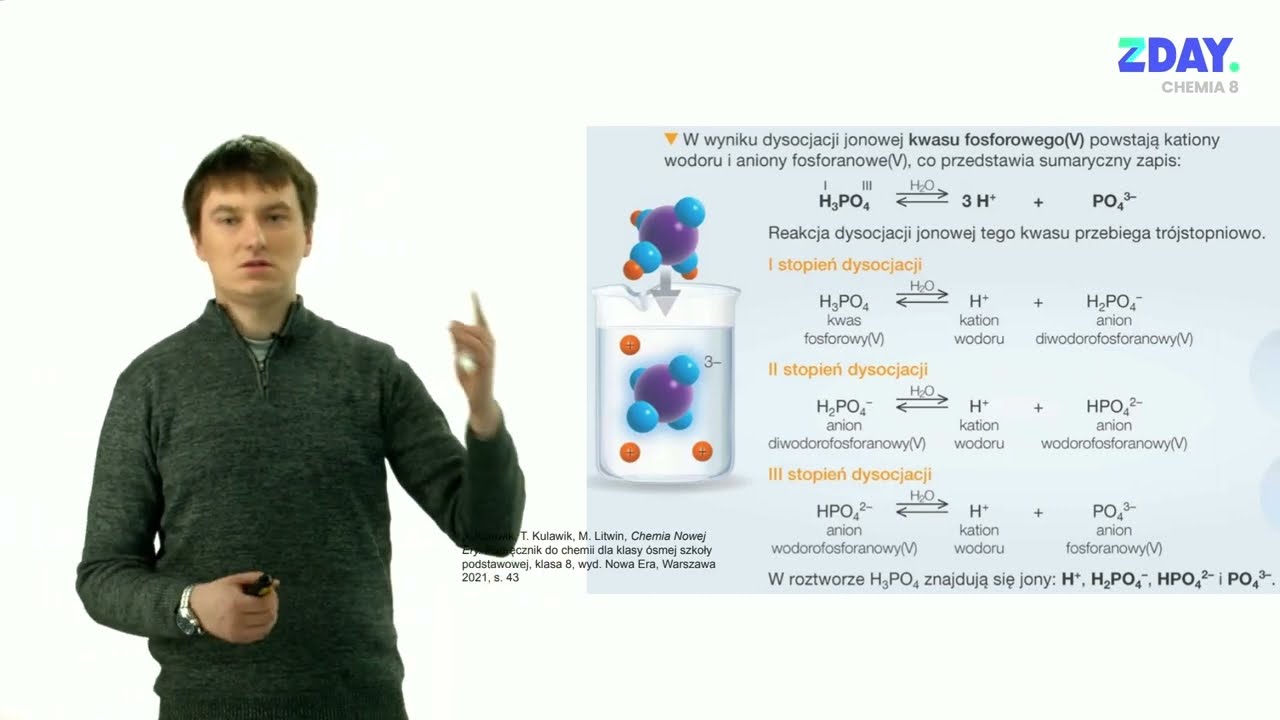
- H3PO4 – kwas fosforowy(V) (kwas ortofosforowy)
- H2CO3 – kwas węglowy
Reakcje charakterystyczne dla kwasów
Zrozumienie reakcji chemicznych, w których biorą udział kwasy, jest kluczowe. Sprawdźmy najczęściej pojawiające się reakcje na sprawdzianach:
- Reakcja z metalami aktywnymi:
Kwas + Metal → Sól + Wodór
Przykład: 2HCl + Mg → MgCl2 + H2
- Reakcja z tlenkami metali (zasadowymi):
Kwas + Tlenek metalu → Sól + Woda
Przykład: H2SO4 + CuO → CuSO4 + H2O
- Reakcja z wodorotlenkami (neutralizacja):
Kwas + Wodorotlenek → Sól + Woda
Przykład: HCl + NaOH → NaCl + H2O
- Reakcja z solami (kwasy mocniejsze wypierają kwasy słabsze z ich soli):
Kwas + Sól → Nowy kwas + Nowa sól
Przykład: H2SO4 + CaCO3 → CaSO4 + H2CO3 (który rozkłada się na H2O i CO2)
Jak rozpoznać kwasy? – Wskaźniki
Wskaźniki, zwane również indykatorami, to substancje, które zmieniają barwę w zależności od pH roztworu. Kilka popularnych wskaźników:
- Lakmus: W środowisku kwasowym – czerwony, w zasadowym – niebieski, obojętny – fioletowy.
- Oranż metylowy: W środowisku kwasowym – czerwony, w zasadowym – żółty, obojętny – pomarańczowy.
- Fenoloftaleina: W środowisku kwasowym – bezbarwna, w zasadowym – malinowa, obojętny - bezbarwna.
- Uniwersalny papierek wskaźnikowy: Zmienia barwę w szerokim zakresie pH, od czerwonej (bardzo kwasowe) do niebieskiej/fioletowej (bardzo zasadowe).
Przykładowe zadania i szybkie rozwiązania
- Zadanie: Napisz równanie reakcji kwasu solnego z magnezem.
Rozwiązanie: 2HCl + Mg → MgCl2 + H2
- Zadanie: Jaki kolor przyjmie lakmus w roztworze kwasu siarkowego(VI)?
Rozwiązanie: Czerwony
- Zadanie: Co powstaje w reakcji neutralizacji kwasu azotowego(V) z wodorotlenkiem potasu?
Rozwiązanie: KNO3 (azotan potasu) i H2O (woda)
- Zadanie: Zidentyfikuj, który z podanych wzorów przedstawia kwas tlenowy: HBr, H2SO4, H2S
Rozwiązanie: H2SO4
Pamiętaj, ćwiczenie czyni mistrza! Przejrzyj podręcznik, rozwiąż zadania ze zbioru, a przede wszystkim – zrozum podstawowe zasady. Powodzenia na sprawdzianie!