Chemia Klasa 8 Sprawdzian Z Soli

Czy sprawdzian z soli w ósmej klasie spędza Ci sen z powiek? Wiem, jak to jest. Chemia potrafi być trudna, a sole wydają się być kolejnym, skomplikowanym rozdziałem. Ale spokojnie, ten artykuł ma Ci pomóc! Razem przejdziemy przez najważniejsze zagadnienia, dzięki którym poczujesz się pewniej i z sukcesem podejdziesz do testu.
Czym właściwie są sole? – Podstawy dla początkujących
Zacznijmy od podstaw. Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Wydaje się skomplikowane? Spróbujmy to uprościć.
Pomyśl o kwasie jako o czymś "kwaśnym" (np. sok z cytryny), a o zasadzie jako o czymś "mydlanym" (np. niektóre środki czyszczące). Kiedy te dwie substancje się połączą, zachodzi reakcja neutralizacji, w wyniku której powstaje sól i woda.
Na przykład: Kwas solny (HCl) + Wodorotlenek sodu (NaOH) → Chlorek sodu (NaCl – sól kuchenna) + Woda (H2O)
Kluczowe pojęcia do zapamiętania:
- Kwas: Substancja, która ma odczyn kwaśny i zawiera jony wodorowe (H+).
- Zasada (Wodorotlenek): Substancja, która ma odczyn zasadowy i zawiera jony wodorotlenkowe (OH-).
- Reakcja neutralizacji: Reakcja kwasu z zasadą, w wyniku której powstaje sól i woda.
- Sól: Związek chemiczny zbudowany z kationu metalu (lub grupy amonowej NH4+) i anionu reszty kwasowej.
Nazewnictwo soli – Jak je odczytać i zapisać?
Kolejnym wyzwaniem jest nazewnictwo soli. Każda sól ma swoją unikalną nazwę, która informuje nas o jej składzie. Nazwa soli składa się z dwóch członów: najpierw podajemy nazwę anionu reszty kwasowej, a następnie nazwę kationu metalu.
Oto kilka przykładów:
- NaCl – Chlorek sodu (anion chlorkowy Cl-, kation sodu Na+)
- CaCO3 – Węglan wapnia (anion węglanowy CO3 2-, kation wapnia Ca 2+)
- K2SO4 – Siarczan(VI) potasu (anion siarczanowy(VI) SO4 2-, kation potasu K+)
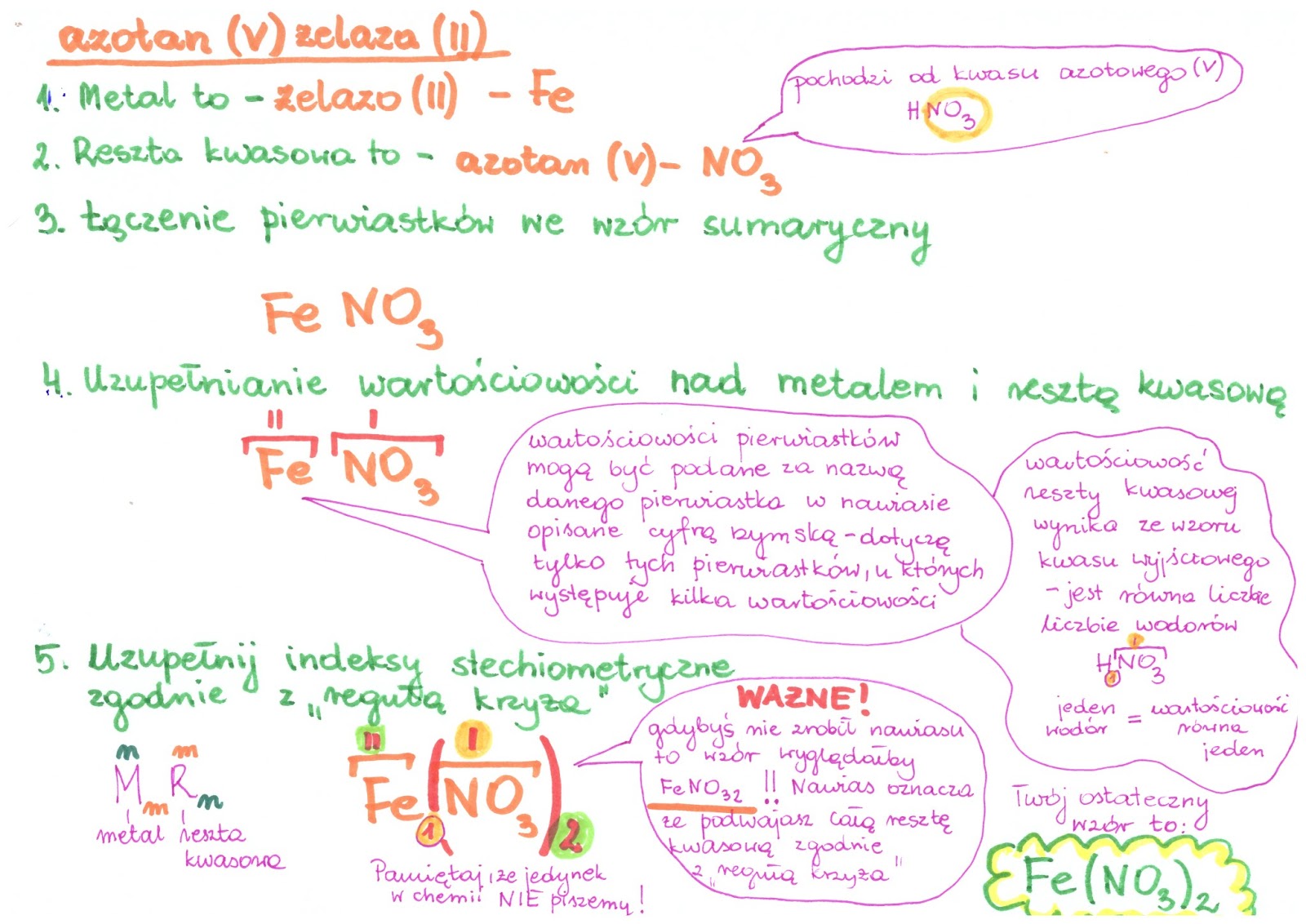
- FeCl3 – Chlorek żelaza(III) (anion chlorkowy Cl-, kation żelaza(III) Fe 3+)
Zwróć uwagę na rzymskie cyfry w nazwach niektórych soli, np. Chlorek żelaza(III). Oznaczają one wartościowość metalu. Żelazo może mieć różne wartościowości, dlatego musimy ją określić w nazwie.
Jak ćwiczyć nazewnictwo? Najlepiej pisząc jak najwięcej wzorów i nazw! Spróbuj sam/a! Znajdź kilka przykładów w podręczniku i sprawdź, czy potrafisz je nazwać. Możesz też skorzystać z internetowych generatorów nazw soli.
Właściwości soli – Co warto wiedzieć?
Sole, jak każdy związek chemiczny, mają swoje charakterystyczne właściwości. Oto kilka najważniejszych:
- Stan skupienia: Większość soli to substancje stałe w temperaturze pokojowej.
- Rozpuszczalność w wodzie: Nie wszystkie sole dobrze rozpuszczają się w wodzie. Niektóre są bardzo dobrze rozpuszczalne, inne prawie wcale. Rozpuszczalność zależy od rodzaju soli i temperatury. Sprawdź tabelę rozpuszczalności soli w podręczniku! To bardzo ważne na sprawdzianie!
- Przewodnictwo elektryczne: Roztwory soli przewodzą prąd elektryczny, ponieważ zawierają jony, które mogą się poruszać i przenosić ładunek elektryczny.
- Smak: Niektóre sole mają charakterystyczny smak (np. chlorek sodu - sól kuchenna), ale nie należy ich próbować w laboratorium! Większość soli jest toksyczna!
Pamiętaj! Właściwości soli zależą od jej składu i budowy. Na sprawdzianie często pojawiają się pytania o rozpuszczalność lub przewodnictwo elektryczne, więc poświęć temu szczególną uwagę.
Otrzymywanie soli – Różne metody, jeden cel
Sole można otrzymać na wiele sposobów. Oto kilka najważniejszych:
- Reakcja kwasu z zasadą (neutralizacja): Jak już wspomnieliśmy, to podstawowa metoda otrzymywania soli. Np. HCl + NaOH → NaCl + H2O
- Reakcja metalu z kwasem: Niektóre metale reagują z kwasami, tworząc sól i wodór. Np. Zn + H2SO4 → ZnSO4 + H2
- Reakcja tlenku metalu z kwasem: Tlenki metali reagują z kwasami, tworząc sól i wodę. Np. CuO + 2HCl → CuCl2 + H2O
- Reakcja metalu z niemetalem: Bezpośrednie połączenie metalu z niemetalem może prowadzić do powstania soli. Np. 2Na + Cl2 → 2NaCl
- Reakcja tlenku kwasowego z zasadą: Tlenki kwasowe reagują z zasadami, tworząc sól i wodę. Np. CO2 + 2NaOH → Na2CO3 + H2O
Zwróć uwagę na różne typy reakcji i zapamiętaj, jakie produkty powstają w każdym z nich. Często na sprawdzianie trzeba napisać równanie reakcji otrzymywania danej soli.
Przykładowe zadania ze sprawdzianu i jak je rozwiązać
Czas na praktykę! Oto kilka typowych zadań, które mogą pojawić się na sprawdzianie z soli, wraz z rozwiązaniami krok po kroku:
- Zadanie: Napisz równanie reakcji otrzymywania siarczanu(VI) miedzi(II) w reakcji tlenku miedzi(II) z kwasem siarkowym(VI).
Rozwiązanie:
Tlenek miedzi(II): CuO
Kwas siarkowy(VI): H2SO4
Siarczan(VI) miedzi(II): CuSO4
Woda: H2O
Równanie reakcji: CuO + H2SO4 → CuSO4 + H2O
- Zadanie: Jakie jony znajdują się w roztworze chlorku potasu (KCl)?
Rozwiązanie:
Chlorek potasu (KCl) dysocjuje w wodzie na jony: K+ (kation potasu) i Cl- (anion chlorkowy).
- Zadanie: Określ, czy azotan(V) srebra(I) (AgNO3) jest rozpuszczalny w wodzie.
Rozwiązanie:
Sprawdzamy w tabeli rozpuszczalności soli. Azotan(V) srebra(I) jest rozpuszczalny w wodzie.
Wskazówka: Zawsze czytaj zadanie uważnie i wypisz dane oraz szukane. To ułatwi Ci rozwiązanie!
Praktyczne wskazówki na sprawdzian
Kilka ostatnich porad, które pomogą Ci osiągnąć sukces na sprawdzianie:
- Powtórz materiał z podręcznika i zeszytu. Skup się na definicjach, nazewnictwie, właściwościach i sposobach otrzymywania soli.
- Rozwiąż jak najwięcej zadań. Im więcej ćwiczysz, tym lepiej zrozumiesz materiał i szybciej będziesz rozwiązywać zadania na sprawdzianie.
- Naucz się na pamięć tabeli rozpuszczalności soli. To bardzo przydatne!
- Zwróć uwagę na jednostki i wzory chemiczne. Pomyłka w jednym znaku może zmienić cały wynik!
- Na sprawdzianie czytaj uważnie polecenia. Upewnij się, że rozumiesz, o co pytają.
- Nie stresuj się! Stres może utrudnić myślenie. Oddychaj głęboko i skoncentruj się na zadaniu.
- Jeżeli masz wątpliwości, zapytaj nauczyciela. Lepiej zapytać, niż popełnić błąd.
Podsumowanie – Jesteś gotowy/a na sprawdzian!
Mam nadzieję, że ten artykuł pomógł Ci lepiej zrozumieć temat soli i przygotować się do sprawdzianu. Pamiętaj, że kluczem do sukcesu jest systematyczna nauka i rozwiązywanie zadań. Trzymam za Ciebie kciuki! Powodzenia!
Dodatkowo, jeśli czujesz, że potrzebujesz więcej pomocy, poszukaj dodatkowych materiałów w internecie, obejrzyj filmy edukacyjne lub poproś o pomoc kolegę lub koleżankę z klasy. Wspólna nauka może być bardzo efektywna!