Chemia Klasa 8 Sprawdzian Sole Pdf

Chemia w ósmej klasie szkoły podstawowej to czas intensywnej nauki, gdzie uczniowie poznają podstawowe pojęcia, które będą fundamentem ich dalszej edukacji chemicznej. Jednym z ważniejszych działów, które omawiane są w tym okresie, są sole. Zrozumienie ich budowy, właściwości, nazewnictwa oraz zastosowań jest kluczowe dla sukcesu na sprawdzianach i późniejszych etapach nauki.
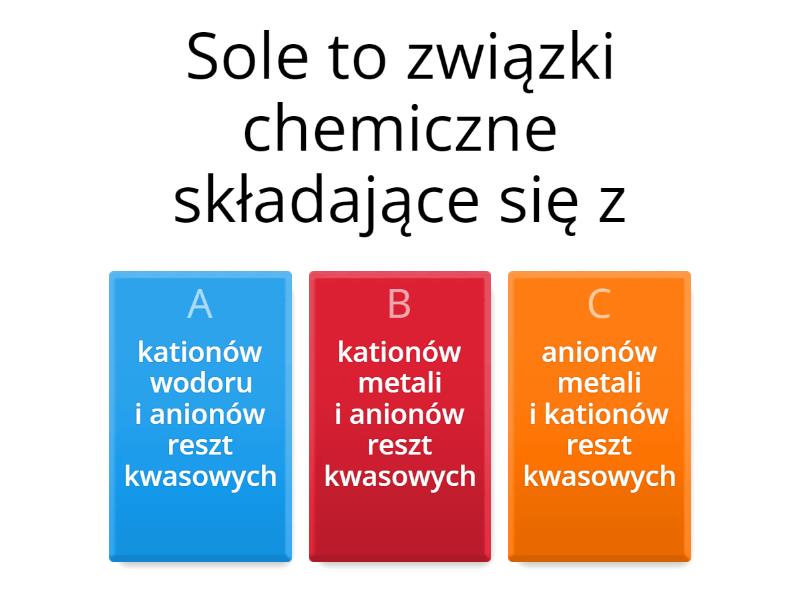
Co to są sole? Definicja i budowa.
Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą, czyli w reakcji neutralizacji. Można je również otrzymać w wyniku reakcji metali z kwasami, tlenków metali z kwasami, niemetali z zasadami (w niektórych przypadkach) oraz reakcji wymiany.
Ogólny wzór soli to Men+Rm-, gdzie:
- Men+ oznacza kation metalu (lub kation amonu NH4+)
- Rm- oznacza anion reszty kwasowej.
Ważne jest, aby zrozumieć, że sole są związkami jonowymi, co oznacza, że w ich strukturze występują jony dodatnie (kationy) i jony ujemne (aniony) połączone siłami elektrostatycznymi. Ta jonowa natura ma wpływ na wiele właściwości soli, takich jak wysoka temperatura topnienia i wrzenia, zdolność do przewodzenia prądu w stanie stopionym lub w roztworze wodnym oraz kruchość w stanie stałym.
Przykłady soli i ich budowa:
- Chlorek sodu (NaCl): Kation sodu (Na+) i anion chlorkowy (Cl-)
- Siarczan miedzi(II) (CuSO4): Kation miedzi(II) (Cu2+) i anion siarczanowy(VI) (SO42-)
- Azotan potasu (KNO3): Kation potasu (K+) i anion azotanowy(V) (NO3-)
Nazewnictwo soli.
Tworzenie nazw soli jest oparte na nazwie reszty kwasowej oraz nazwie metalu (lub grupy amonowej). Istnieją pewne zasady, których należy przestrzegać:
- Nazwa reszty kwasowej: Nazwa anionu pochodzi od nazwy kwasu, od którego pochodzi ta reszta. Na przykład, reszta kwasowa pochodząca od kwasu chlorowodorowego (HCl) to chlorek (Cl-), a reszta pochodząca od kwasu siarkowego(VI) (H2SO4) to siarczan(VI) (SO42-).
- Nazwa metalu: Nazwę metalu podaje się w dopełniaczu. Jeżeli metal tworzy tylko jeden typ jonu (np. sód, potas), nazwa jest prosta (np. chlorek sodu). Jeżeli metal tworzy jony o różnych wartościowościach (np. żelazo, miedź), należy podać w nawiasie wartośćowości metalu cyframi rzymskimi (np. chlorek żelaza(II), chlorek żelaza(III)).
Przykłady nazewnictwa:
- FeCl2: Chlorek żelaza(II)
- FeCl3: Chlorek żelaza(III)
- CuSO4: Siarczan(VI) miedzi(II)
- Na2CO3: Węglan sodu
- NH4NO3: Azotan(V) amonu
Właściwości soli.
Właściwości soli zależą od ich budowy jonowej. Do najważniejszych należą:
- Stan skupienia: Sole w temperaturze pokojowej są na ogół substancjami stałymi.
- Temperatura topnienia i wrzenia: Mają wysokie temperatury topnienia i wrzenia, co wynika z silnych oddziaływań elektrostatycznych między jonami.
- Rozpuszczalność w wodzie: Rozpuszczalność soli w wodzie jest zróżnicowana. Niektóre sole są bardzo dobrze rozpuszczalne, inne słabo, a jeszcze inne praktycznie nierozpuszczalne. Rozpuszczalność zależy od rodzaju jonów i oddziaływań między nimi a cząsteczkami wody. Tabele rozpuszczalności pozwalają przewidywać, czy dana sól jest rozpuszczalna.
- Przewodnictwo elektryczne: Sole w stanie stałym nie przewodzą prądu elektrycznego. Natomiast roztwory wodne soli i stopione sole przewodzą prąd elektryczny, ponieważ zawierają ruchliwe jony.
- Smak: Niektóre sole mają charakterystyczny smak (np. chlorek sodu - sól kuchenna).
Reakcje otrzymywania soli.
Sole można otrzymać w wyniku różnych reakcji chemicznych. Najważniejsze z nich to:
- Reakcja kwasu z zasadą (neutralizacja): Kwas + Zasada → Sól + Woda.
Przykład: HCl + NaOH → NaCl + H2O
- Reakcja metalu z kwasem: Metal + Kwas → Sól + Wodór.
Przykład: Zn + H2SO4 → ZnSO4 + H2
- Reakcja tlenku metalu z kwasem: Tlenek metalu + Kwas → Sól + Woda.
Przykład: CuO + 2HCl → CuCl2 + H2O
- Reakcja metalu z niemetalem: Metal + Niemetal → Sól.
Przykład: 2Na + Cl2 → 2NaCl
- Reakcja wymiany: Sól A + Sól B → Sól C + Sól D (jeśli powstaje osad). Reakcja zachodzi, jeśli przynajmniej jeden z produktów jest nierozpuszczalny i wytrąca się jako osad.
Przykład: AgNO3 + NaCl → AgCl↓ + NaNO3 (AgCl jest nierozpuszczalny i wytrąca się jako biały osad)
Zastosowania soli.
Sole mają szerokie zastosowanie w różnych dziedzinach. Oto kilka przykładów:
- Przemysł spożywczy: Chlorek sodu (NaCl) – sól kuchenna, używana jako przyprawa i konserwant.
- Rolnictwo: Nawozy mineralne, takie jak azotany, fosforany i sole potasowe, dostarczają roślinom niezbędnych składników odżywczych.
- Medycyna: Roztwory soli fizjologicznej (NaCl) stosowane do nawadniania organizmu i przemywania ran. Węglan sodu (NaHCO3) – soda oczyszczona, używana jako lek zobojętniający kwas żołądkowy.
- Przemysł chemiczny: Sole są wykorzystywane jako substraty w wielu procesach chemicznych, np. do produkcji innych związków chemicznych, barwników, tworzyw sztucznych.
- Budownictwo: Siarczan wapnia (CaSO4) – gips, używany do wyrobu materiałów budowlanych.
- Laboratorium chemiczne: odczynniki chemiczne.
Jak przygotować się do sprawdzianu z soli?
Przygotowanie do sprawdzianu z soli wymaga systematycznej nauki i zrozumienia kluczowych pojęć. Oto kilka wskazówek:
- Powtórz definicję soli: Upewnij się, że rozumiesz, czym są sole i jak powstają.
- Naucz się nazewnictwa soli: Ćwicz tworzenie nazw soli na podstawie ich wzorów chemicznych i odwrotnie.
- Zapamiętaj właściwości soli: Zwróć uwagę na stan skupienia, temperaturę topnienia i wrzenia, rozpuszczalność w wodzie oraz przewodnictwo elektryczne.
- Naucz się reakcji otrzymywania soli: Zrozum, jakie reakcje prowadzą do powstania soli i zapisuj równania reakcji.
- Rozwiązuj zadania: Ćwicz rozwiązywanie zadań dotyczących obliczeń stechiometrycznych, przewidywania produktów reakcji i identyfikacji soli.
- Korzystaj z podręcznika i materiałów dodatkowych: Czytaj podręcznik, korzystaj z notatek z lekcji, a także z dodatkowych materiałów edukacyjnych, takich jak karty pracy, testy i prezentacje multimedialne. W Internecie dostępnych jest wiele zasobów edukacyjnych, w tym pliki PDF z sprawdzianami z soli, które mogą być pomocne w przygotowaniu się do sprawdzianu. Szukaj fraz kluczowych takich jak: "chemia klasa 8 sprawdzian sole pdf".
- Ucz się regularnie: Nie zostawiaj nauki na ostatnią chwilę. Rozłóż materiał na mniejsze porcje i ucz się regularnie, aby lepiej zapamiętać i zrozumieć zagadnienia.
- Korzystaj z pomocy nauczyciela i kolegów: Jeśli masz trudności ze zrozumieniem jakiegoś zagadnienia, poproś o pomoc nauczyciela lub kolegów z klasy. Wspólna nauka może być bardzo efektywna.
Pamiętaj, że kluczem do sukcesu jest zrozumienie podstawowych pojęć i umiejętność ich zastosowania w praktyce. Powodzenia na sprawdzianie!
Podsumowanie
Sole to kluczowa grupa związków chemicznych, których zrozumienie jest niezbędne w dalszej edukacji chemicznej. Znajomość ich definicji, budowy, nazewnictwa, właściwości, reakcji otrzymywania i zastosowań pozwoli Ci na zdobycie dobrej oceny na sprawdzianie i rozwijanie swojej wiedzy chemicznej. Pamiętaj o systematycznej nauce, rozwiązywaniu zadań i korzystaniu z dostępnych materiałów edukacyjnych. Znalezienie i wykorzystanie sprawdzianów w formie PDF to wartościowe wsparcie w procesie przygotowań. Powodzenia!