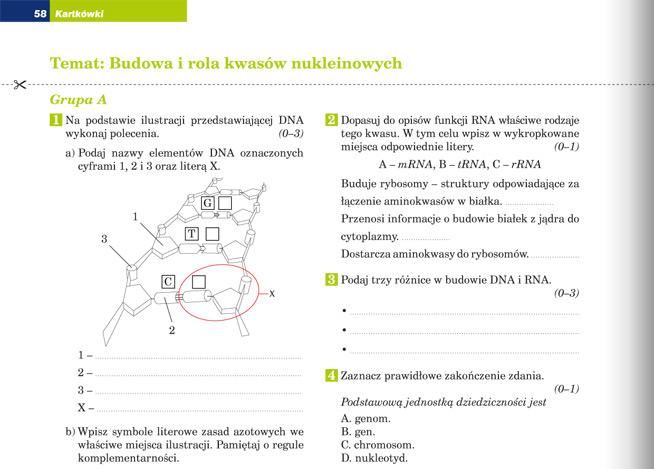
Chemia Klasa 2 Gimnazjum Sprawdzian Dzial Kwasy

Chemia w drugiej klasie gimnazjum to czas, w którym poznajemy fascynujący świat kwasów. Zrozumienie ich właściwości i reakcji jest kluczowe do dalszej nauki chemii. Niniejszy artykuł ma na celu pomóc w przygotowaniu się do sprawdzianu z działu "Kwasy", omawiając najważniejsze zagadnienia w sposób zrozumiały i usystematyzowany.
Czym są Kwasy? Podstawowe Definicje
Definicja kwasu wg Arrheniusa
Według teorii Arrheniusa, kwas to substancja, która w roztworze wodnym dysocjuje, tworząc jony wodorowe (H+). To właśnie obecność tych jonów determinuje kwaśny charakter roztworu.
Definicja kwasu wg Brønsteda-Lowry'ego
Bardziej ogólną definicję proponują Brønsted i Lowry. Według nich, kwas to donor protonu (H+). Oznacza to, że kwas jest substancją, która oddaje proton innej substancji, nazywanej zasadą.
Właściwości kwasów
Kwasy charakteryzują się pewnymi charakterystycznymi właściwościami, które pozwalają na ich identyfikację:
- Kwaśny smak: Chociaż nigdy nie wolno próbować kwasów w laboratorium, ich smak jest kwaśny (np. sok z cytryny zawiera kwas cytrynowy).
- Reakcja z metalami: Większość kwasów reaguje z metalami, tworząc sól i wydzielając wodór (H2).
- Zmiana barwy wskaźników: Kwasy zmieniają barwę wskaźników, np. lakmus zmienia się na czerwono, a oranż metylowy na różowo. Fenoloftaleina pozostaje bezbarwna w roztworach kwasów.
- Reakcja z zasadami: Kwasy reagują z zasadami, tworząc sól i wodę (reakcja zobojętniania).
Nomenklatura Kwasów
Kwasy beztlenowe
Kwasy beztlenowe, czyli takie, które w swojej budowie nie zawierają atomów tlenu, mają nazwy utworzone od nazwy niemetalu z dodatkiem słowa "kwas" oraz przedrostka "wodo-". Przykłady:
- HCl – kwas chlorowodorowy (inaczej solny)
- H2S – kwas siarkowodorowy
- HF - kwas fluorowodorowy
Kwasy tlenowe
Nazewnictwo kwasów tlenowych jest bardziej złożone i zależy od stopnia utlenienia niemetalu tworzącego kwas. Najczęściej spotykane są:
- HNO3 – kwas azotowy(V)
- H2SO4 – kwas siarkowy(VI)
- H3PO4 – kwas fosforowy(V)
- H2CO3 – kwas węglowy
W nazwach kwasów tlenowych używa się rzymskich cyfr, oznaczających stopień utlenienia niemetalu w danym kwasie.
Dysocjacja Kwasów
Dysocjacja kwasowa to proces rozpadu kwasu na jony w roztworze wodnym. Stopień dysocjacji zależy od siły kwasu. Silne kwasy dysocjują w znacznym stopniu, natomiast słabe kwasy – w niewielkim stopniu.
Przykładowe równanie dysocjacji kwasu solnego:
HCl → H+ + Cl-
Reakcje Kwasów
Reakcja z metalami
Kwasy reagują z metalami aktywnymi (znajdującymi się w szeregu aktywności metali przed wodorem), tworząc sól i wodór. Na przykład:
Zn + 2HCl → ZnCl2 + H2
Reakcja z tlenkami metali
Kwasy reagują z tlenkami metali, tworząc sól i wodę. Na przykład:
CuO + H2SO4 → CuSO4 + H2O
Reakcja z wodorotlenkami (zobojętnianie)
Reakcja kwasu z wodorotlenkiem nazywana jest reakcją zobojętniania. Produktami są sól i woda. Na przykład:
NaOH + HCl → NaCl + H2O
Reakcja z solami
Kwas może reagować z solą, jeśli powstaje słabszy kwas lub osad. Na przykład:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
W tym przypadku powstaje słaby kwas węglowy (H2CO3), który rozkłada się na wodę i dwutlenek węgla.
Zastosowania Kwasów
Kwasy mają szerokie zastosowanie w przemyśle i życiu codziennym. Przykłady:
- Kwas siarkowy(VI) (H2SO4): Produkcja nawozów, tworzyw sztucznych, detergentów, akumulatorów.
- Kwas chlorowodorowy (HCl): Przemysł spożywczy (np. jako regulator kwasowości), produkcja klejów, odkamienianie.
- Kwas azotowy(V) (HNO3): Produkcja nawozów, materiałów wybuchowych.
- Kwas octowy (CH3COOH): Przemysł spożywczy (ocet), produkcja tworzyw sztucznych.
Bezpieczeństwo Pracy z Kwasami
Praca z kwasami wymaga zachowania szczególnej ostrożności. Kwasy są substancjami żrącymi i mogą powodować poważne oparzenia skóry i oczu. Należy zawsze stosować odpowiednie środki ochrony osobistej, takie jak okulary ochronne, rękawice i fartuch. W przypadku kontaktu kwasu ze skórą należy natychmiast przemyć to miejsce dużą ilością wody.
Pamiętaj, że zrozumienie definicji, właściwości, reakcji i zastosowań kwasów jest kluczowe do sukcesu na sprawdzianie z chemii. Powodzenia!