Chemia Atomy I Cząsteczki Klasa 7

Witajcie, drodzy uczniowie klasy 7! W tym artykule zgłębimy fascynujący świat chemii, skupiając się na podstawowych budulcach materii: atomach i cząsteczkach. Zrozumienie tych pojęć jest kluczowe do dalszej nauki chemii i poznawania otaczającego nas świata. Spróbujemy odpowiedzieć na pytania: czym są atomy, z czego się składają, jak łączą się ze sobą tworząc cząsteczki i jak to wszystko wpływa na właściwości substancji?
Czym są Atomy? Fundament Materii
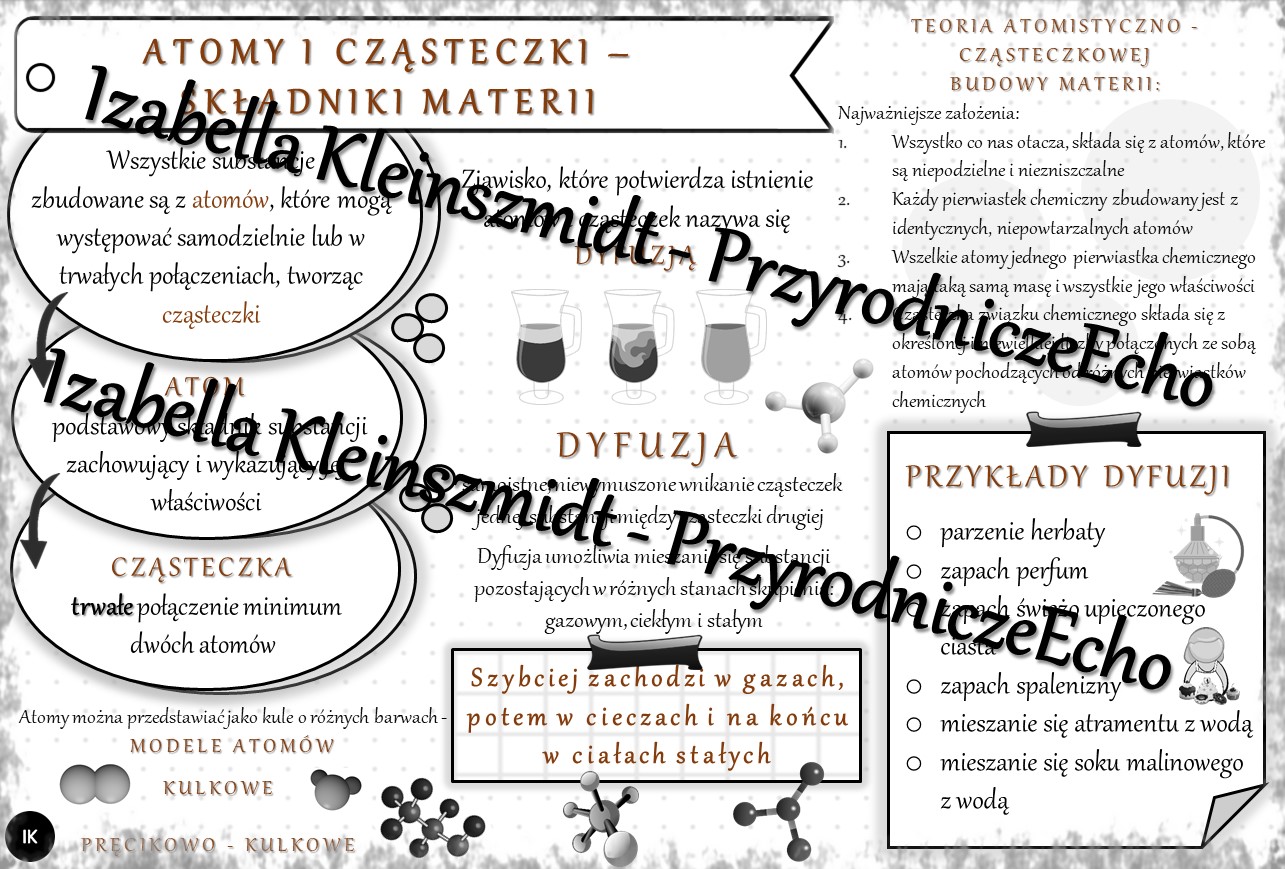
Atomy to najmniejsze jednostki pierwiastków chemicznych, które zachowują ich charakterystyczne właściwości. Wyobraźcie sobie, że macie kawałek złota. Możecie go dzielić na coraz mniejsze kawałki, ale w pewnym momencie dojdziecie do najmniejszej cząstki, która nadal będzie złotem – właśnie do atomu złota. Jeśli podzielilibyście go dalej, przestanie to być złoto.
Budowa Atomu
Atomy nie są niepodzielne! Składają się z jeszcze mniejszych cząstek, zwanych cząstkami subatomowymi. Najważniejsze z nich to:
- Protony: Cząstki o ładunku dodatnim, znajdujące się w jądrze atomowym. Ilość protonów decyduje o tym, jakim pierwiastkiem jest dany atom (np. atom posiadający 1 proton to zawsze atom wodoru).
- Neutrony: Cząstki obojętne elektrycznie (nie mają ładunku), również znajdujące się w jądrze atomowym. Razem z protonami tworzą masę atomu.
- Elektrony: Cząstki o ładunku ujemnym, krążące wokół jądra atomowego po tzw. orbitalach. Ich ilość jest zwykle równa liczbie protonów w atomie, co sprawia, że atom jako całość jest elektrycznie obojętny.
Wyobraźcie sobie, że jądro atomowe to Słońce, a elektrony to planety krążące wokół niego. Oczywiście, elektrony nie krążą po dokładnie określonych orbitach jak planety, ale model ten pomaga zrozumieć strukturę atomu.
Przykład: Atom węgla (C) ma 6 protonów, 6 neutronów i 6 elektronów. To właśnie obecność 6 protonów definiuje go jako węgiel.
Liczba Atomowa i Liczba Masowa
Aby uporządkować informacje o atomach, używamy dwóch ważnych pojęć:
- Liczba atomowa (Z): To liczba protonów w jądrze atomowym. Jest to charakterystyczna liczba dla każdego pierwiastka i znajduje się w układzie okresowym pierwiastków. Na przykład, liczba atomowa wodoru (H) wynosi 1, a tlenu (O) wynosi 8.
- Liczba masowa (A): To suma liczby protonów i neutronów w jądrze atomowym. Określa masę atomu. Na przykład, atom węgla (C) o 6 protonach i 6 neutronach ma liczbę masową 12.
Przykład: Spójrzcie na układ okresowy pierwiastków. Każdy pierwiastek ma przypisaną liczbę atomową, która informuje nas o liczbie protonów w jego atomie. To fundamentalna informacja o danym pierwiastku.
Cząsteczki: Atomy Łączą Siły
Cząsteczki powstają, gdy dwa lub więcej atomów łączy się ze sobą za pomocą wiązań chemicznych. Wiązania te wynikają z oddziaływań między elektronami atomów. Cząsteczki mogą być bardzo proste (np. cząsteczka tlenu O2, składająca się z dwóch atomów tlenu) lub bardzo złożone (np. cząsteczki białek, składające się z tysięcy atomów).
Rodzaje Wiązań Chemicznych
Istnieje wiele rodzajów wiązań chemicznych, ale do najważniejszych należą:
- Wiązanie kowalencyjne: Powstaje, gdy atomy *wspólnie* korzystają z elektronów. Dzieje się tak, gdy atomy mają podobną elektroujemność (czyli zdolność przyciągania elektronów). Przykładem jest cząsteczka wody (H2O), gdzie atomy wodoru i tlenu wspólnie korzystają z elektronów.
- Wiązanie jonowe: Powstaje, gdy jeden atom *oddaje* elektron drugiemu atomowi. Dzieje się tak, gdy atomy mają bardzo różną elektroujemność. Atom, który oddaje elektron, staje się jonem dodatnim (kationem), a atom, który przyjmuje elektron, staje się jonem ujemnym (anionem). Przykładem jest chlorek sodu (NaCl), czyli sól kuchenna, gdzie atom sodu (Na) oddaje elektron atomowi chloru (Cl).
Przykład: Wyobraźcie sobie, że wiązanie kowalencyjne to dzielenie się zabawkami między przyjaciółmi, a wiązanie jonowe to sytuacja, w której jeden przyjaciel oddaje zabawkę drugiemu na stałe.
Wzory Chemiczne i Masa Cząsteczkowa
Wzory chemiczne to skrócony sposób zapisu składu cząsteczki. Pokazują, jakie pierwiastki wchodzą w skład cząsteczki i w jakiej proporcji. Na przykład:
- H2O – woda (dwie atomy wodoru i jeden atom tlenu)
- CO2 – dwutlenek węgla (jeden atom węgla i dwa atomy tlenu)
- NaCl – chlorek sodu (jeden atom sodu i jeden atom chloru)
Masa cząsteczkowa to suma mas atomowych wszystkich atomów wchodzących w skład cząsteczki. Jest wyrażana w jednostkach masy atomowej (u). Można ją obliczyć, korzystając z układu okresowego pierwiastków.
Przykład: Masa cząsteczkowa wody (H2O) wynosi około 18 u (1 u + 1 u + 16 u = 18 u), ponieważ masa atomowa wodoru wynosi około 1 u, a masa atomowa tlenu wynosi około 16 u.
Atomy i Cząsteczki w Życiu Codziennym
Atomy i cząsteczki są wszędzie! Stanowią budulec wszystkiego, co nas otacza: powietrza, wody, jedzenia, ubrań, a nawet nas samych. Zrozumienie ich właściwości pozwala nam wyjaśnić wiele zjawisk, które obserwujemy w życiu codziennym.
Przykłady zastosowań
- Gotowanie: Podczas gotowania zachodzą reakcje chemiczne, w których cząsteczki przekształcają się w inne. Na przykład, smażenie jajka powoduje denaturację białek, czyli zmianę ich struktury.
- Oddychanie: Podczas oddychania wdychamy tlen (O2), który jest niezbędny do spalania pokarmu w komórkach i uwalniania energii. Wydychamy dwutlenek węgla (CO2), który jest produktem ubocznym tego procesu.
- Materiały: Różne materiały (np. plastik, metal, drewno) mają różne właściwości ze względu na różny skład i strukturę cząsteczkową. Na przykład, diament jest bardzo twardy, ponieważ atomy węgla są w nim silnie połączone w trójwymiarową sieć.
- Leki: Leki działają, ponieważ ich cząsteczki oddziałują z cząsteczkami w naszym organizmie, wpływając na jego funkcjonowanie.
Przykład: Rozejrzyjcie się dookoła! Wszystko, co widzicie, składa się z atomów i cząsteczek. Nawet powietrze, którym oddychacie, to mieszanina cząsteczek azotu (N2), tlenu (O2) i innych gazów.
Podsumowanie i Co Dalej?
Gratulacje! Przeszliście przez podstawy wiedzy o atomach i cząsteczkach. Pamiętajcie, że:
- Atomy są najmniejszymi jednostkami pierwiastków chemicznych.
- Cząsteczki powstają, gdy atomy łączą się ze sobą.
- Wiązania chemiczne utrzymują atomy razem w cząsteczkach.
- Wzory chemiczne pokazują skład cząsteczek.
- Atomy i cząsteczki są wszędzie wokół nas i wpływają na nasze życie.
Aby pogłębić swoją wiedzę, możecie:
- Czytać książki i artykuły o chemii.
- Oglądać filmy edukacyjne na YouTube.
- Przeprowadzać proste eksperymenty chemiczne pod opieką dorosłych.
- Zadać pytania nauczycielowi chemii lub starszym kolegom.
Chemia to fascynująca dziedzina nauki, która pozwala nam zrozumieć świat wokół nas. Mam nadzieję, że ten artykuł zachęcił Was do dalszego zgłębiania jej tajemnic! Powodzenia w dalszej nauce!
Pamiętaj! Zrozumienie atomów i cząsteczek to fundament do dalszej nauki chemii i zrozumienia otaczającego nas świata. Nie bój się pytać i eksperymentować!