Budowa Kwasów Karboksylowych

Kwasy karboksylowe stanowią jedną z najważniejszych grup związków organicznych, odgrywających fundamentalną rolę w chemii, biologii i przemyśle. Ich wszechobecność wynika z charakterystycznej budowy i właściwości, które determinują ich reaktywność i zastosowania. Zrozumienie budowy kwasów karboksylowych jest kluczowe dla zrozumienia wielu procesów chemicznych i biologicznych.
Budowa Kwasu Karboksylowego: Podstawy
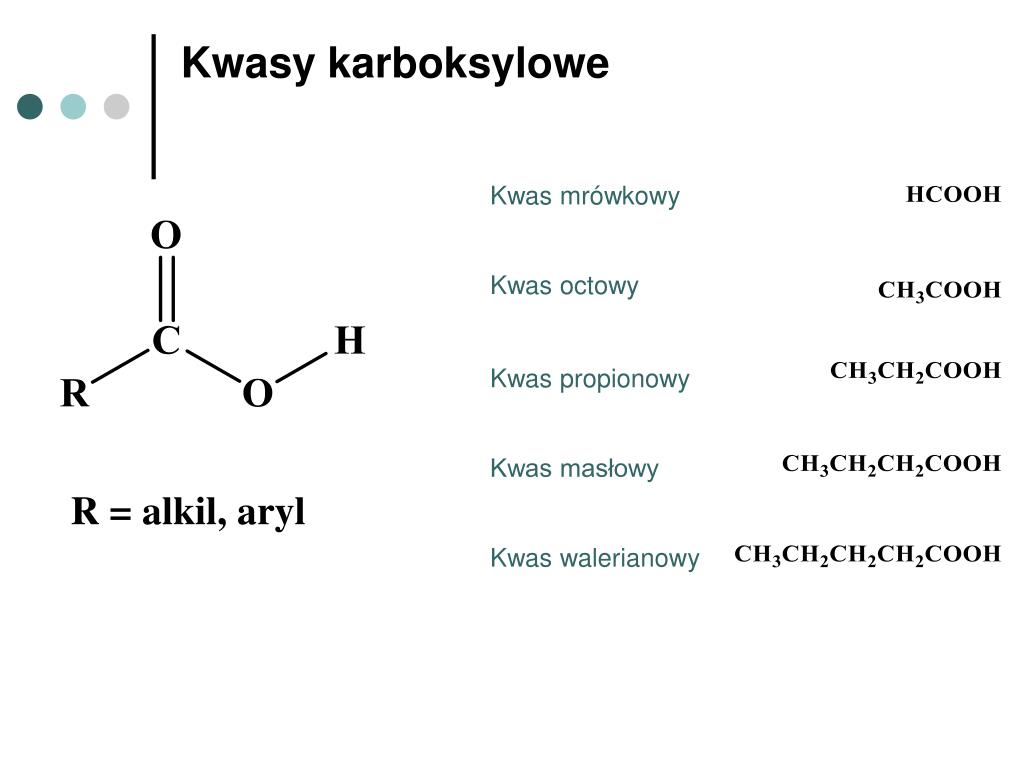
Kwas karboksylowy charakteryzuje się obecnością grupy funkcyjnej karboksylowej (-COOH). Ta grupa składa się z dwóch części: grupy karbonylowej (C=O) oraz grupy hydroksylowej (-OH) połączonych z tym samym atomem węgla. Atomy węgla w grupie karboksylowej wykazują hybrydyzację sp2, co oznacza, że cząsteczka ma geometrię płaską wokół tego atomu.
Grupa Karbonylowa (C=O)
Grupa karbonylowa, obecna również w aldehydach i ketonach, posiada podwójne wiązanie pomiędzy atomem węgla a atomem tlenu. Tlen jest bardziej elektroujemny niż węgiel, co powoduje polaryzację wiązania C=O. Atom tlenu uzyskuje częściowy ładunek ujemny (δ-), a atom węgla częściowy ładunek dodatni (δ+). Ta polaryzacja sprawia, że atom węgla w grupie karbonylowej jest elektrofilowy, a zatem podatny na atak nukleofilowy.
Grupa Hydroksylowa (-OH)
Grupa hydroksylowa, znana z alkoholi, nadaje cząsteczce kwasy karboksylowego zdolność do tworzenia wiązań wodorowych. Atom tlenu w grupie hydroksylowej jest połączony z atomem wodoru, który jest elektrofilowy i może oddziaływać z innymi atomami o wysokiej elektroujemności, takimi jak tlen lub azot. Obecność grupy hydroksylowej wpływa na wysoką temperaturę wrzenia kwasów karboksylowych w porównaniu z alkanami o podobnej masie cząsteczkowej.
Wpływ Hybrydyzacji sp2
Hybrydyzacja sp2 atomu węgla w grupie karboksylowej determinuje płaską strukturę wokół tego atomu. To z kolei wpływa na przestrzenne ułożenie atomów i ich dostępność do reakcji chemicznych. Ponadto, obecność niezhybrydyzowanego orbitalu p pozwala na powstanie wiązania π, które stabilizuje cząsteczkę.
Rezonans w Grupie Karboksylowej
Grupa karboksylowa wykazuje rezonans, co oznacza, że elektrony są zdelokalizowane pomiędzy trzema atomami: węglem oraz dwoma atomami tlenu. Rezonans prowadzi do powstania struktur rezonansowych, które opisują rozkład ładunku elektronowego w cząsteczce. Dzięki rezonansowi, wiązanie C-O w grupie karboksylowej jest częściowo podwójne, a wiązanie C=O jest częściowo pojedyncze. Stabilizuje to grupę karboksylową i wpływa na jej reaktywność.
Kwasowość Kwasów Karboksylowych
Kwasy karboksylowe są kwasami Brønsteda, co oznacza, że są zdolne do oddawania protonów (H+). Kwasowość kwasów karboksylowych wynika z faktu, że anion karboksylanowy (RCOO-) jest stabilizowany rezonansowo. Po oddaniu protonu przez kwas karboksylowy, ujemny ładunek jest zdelokalizowany pomiędzy dwoma atomami tlenu, co obniża energię anionu i zwiększa stabilność. Im bardziej stabilny anion, tym silniejszy kwas.
Czynniki Wpływające na Kwasowość
Na kwasowość kwasów karboksylowych wpływa szereg czynników, w tym:
- Efekt indukcyjny: Podstawniki elektroujemne (np. chlor, fluor) w pobliżu grupy karboksylowej zwiększają kwasowość, ponieważ stabilizują anion karboksylanowy, odciągając gęstość elektronową. Podstawniki elektrondonorowe (np. grupy alkilowe) zmniejszają kwasowość.
- Efekt rezonansowy: Podstawniki, które mogą uczestniczyć w rezonansie z grupą karboksylanową, również wpływają na kwasowość.
- Efekt pola: Efekt pola odnosi się do wpływu ładunku elektrycznego podstawnika na kwasowość.
Nomenklatura Kwasów Karboksylowych
Nazewnictwo kwasów karboksylowych opiera się na dwóch systemach: trywialnym i systematycznym (IUPAC). Nazwy trywialne są historyczne i często odzwierciedlają źródło, z którego dany kwas został po raz pierwszy wyizolowany. Nazwy systematyczne są tworzone zgodnie z zasadami IUPAC.
Nazewnictwo Systematyczne (IUPAC)
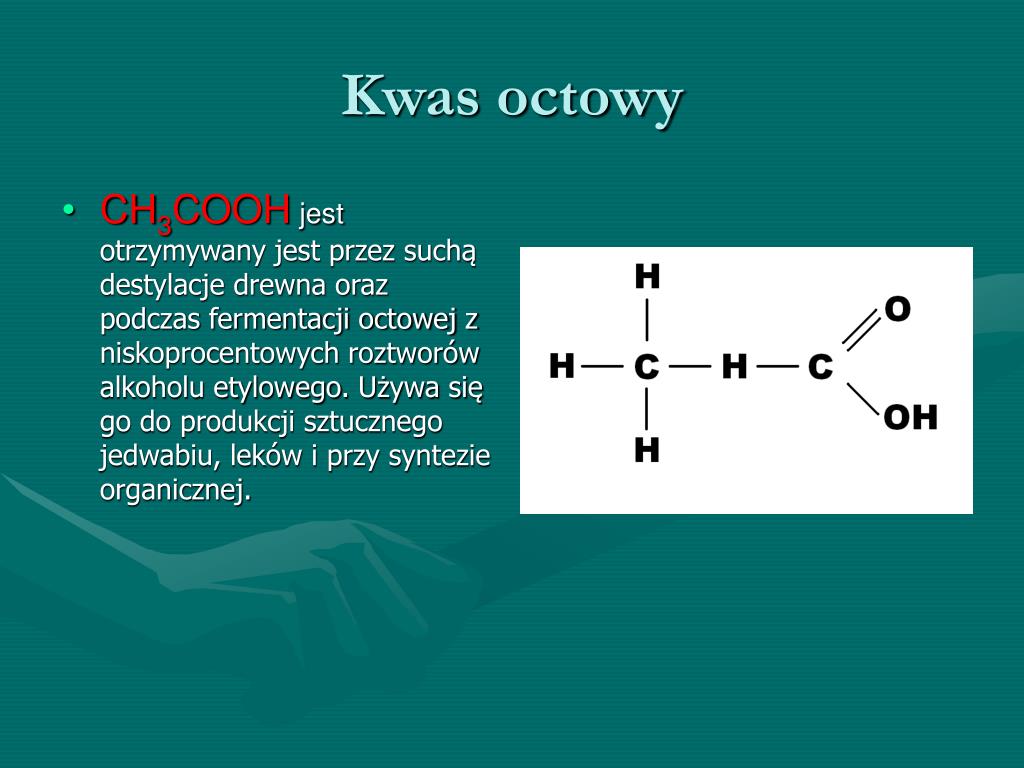
W nazewnictwie systematycznym, kwas karboksylowy nazywa się, dodając końcówkę "-owy" do nazwy alkanu o tej samej liczbie atomów węgla. Atom węgla w grupie karboksylowej jest zawsze oznaczany numerem 1. Na przykład, kwas o wzorze CH3COOH nazywa się kwasem etanowym (trywialnie kwas octowy), ponieważ zawiera dwa atomy węgla.
Nazewnictwo Trywialne
Wiele kwasów karboksylowych posiada powszechnie używane nazwy trywialne, które często są związane z ich pochodzeniem. Przykłady:
- Kwas mrówkowy (HCOOH) - nazwa pochodzi od łacińskiego słowa "formica" (mrówka), ponieważ został po raz pierwszy wyizolowany z mrówek.
- Kwas octowy (CH3COOH) - nazwa pochodzi od łacińskiego słowa "acetum" (ocet).
- Kwas masłowy (CH3CH2CH2COOH) - nazwa pochodzi od łacińskiego słowa "butyrum" (masło).
Przykłady Kwasów Karboksylowych i Ich Zastosowania
Kwasy karboksylowe znajdują szerokie zastosowanie w różnych dziedzinach.
- Kwas octowy (CH3COOH) - stosowany w przemyśle spożywczym (ocet), chemicznym (produkcja tworzyw sztucznych, włókien syntetycznych) oraz farmaceutycznym.
- Kwas cytrynowy (C6H8O7) - stosowany jako dodatek do żywności (regulator kwasowości, konserwant), w kosmetyce i farmacji.
- Kwas benzoesowy (C7H6O2) - stosowany jako konserwant w żywności i lekach, a także w produkcji barwników i tworzyw sztucznych.
- Kwasy tłuszczowe - stanowią składnik tłuszczów roślinnych i zwierzęcych, odgrywają kluczową rolę w metabolizmie i są wykorzystywane w produkcji mydeł i detergentów. Przykładowo, kwas stearynowy (C18H36O2) jest powszechnym składnikiem mydeł.
Kwasy Karboksylowe w Biologii
Kwasy karboksylowe odgrywają kluczową rolę w procesach biologicznych. Aminokwasy, budujące białka, posiadają zarówno grupę karboksylową, jak i grupę aminową. Cykl Krebsa (cykl kwasu cytrynowego), kluczowy szlak metaboliczny zachodzący w mitochondriach, wykorzystuje kwasy karboksylowe jako substraty i produkty pośrednie. Kwasy tłuszczowe stanowią ważne źródło energii i budulec błon komórkowych.
Podsumowanie
Kwasy karboksylowe charakteryzują się obecnością grupy karboksylowej (-COOH), która nadaje im specyficzne właściwości i reaktywność. Ich budowa, w tym polaryzacja wiązań, rezonans i hybrydyzacja atomów, determinuje ich kwasowość i zdolność do tworzenia wiązań wodorowych. Kwasy karboksylowe znajdują szerokie zastosowanie w przemyśle, medycynie i biologii, co czyni je jedną z najważniejszych grup związków organicznych. Zrozumienie ich budowy i właściwości jest fundamentalne dla każdego, kto zajmuje się chemią.