Budowa Atomu Układ Okresowy Pierwiastków Chemicznych Sprawdzian

Dzień dobry wszystkim! Widzę, że macie trochę pytań dotyczących budowy atomu, układu okresowego i sprawdzianu. Postaram się wszystko wyjaśnić najprościej jak potrafię.
Zacznijmy od podstaw, czyli od tego, z czego składa się atom. Wyobraźcie sobie atom jako mały układ słoneczny. W samym centrum znajduje się jądro atomowe. W jądrze siedzą dwa rodzaje cząstek: protony i neutrony. Protony mają ładunek dodatni (+), a neutrony są obojętne, czyli nie mają żadnego ładunku. Ilość protonów w jądrze decyduje o tym, jaki to jest pierwiastek. Na przykład, każdy atom, który ma jeden proton, to atom wodoru. Atom z dwoma protonami to hel i tak dalej.
Wokół jądra krążą elektrony. Elektrony mają ładunek ujemny (-). Krążą one po pewnych "ścieżkach" zwanych orbitalami lub powłokami elektronowymi. Można sobie wyobrazić, że są to takie "półki" na których mogą przebywać elektrony. Pierwsza powłoka, najbliższa jądra, może pomieścić maksymalnie dwa elektrony. Druga powłoka może pomieścić do ośmiu elektronów, a kolejne powłoki mogą pomieścić jeszcze więcej.
Elektrony nie krążą sobie ot tak, losowo. Muszą wypełniać powłoki zgodnie z pewnymi zasadami. Zawsze najpierw zapełniają się powłoki najbliższe jądra, czyli te o najniższej energii. Dopiero gdy pierwsza powłoka jest pełna, elektrony zaczynają zajmować drugą powłokę i tak dalej.
Teraz porozmawiajmy o liczbie atomowej (Z) i liczbie masowej (A). Liczba atomowa to nic innego jak liczba protonów w jądrze atomu danego pierwiastka. Jak już wspominałem, ta liczba decyduje o tym, jaki to jest pierwiastek. Na przykład, liczba atomowa węgla to 6, co oznacza, że atom węgla ma 6 protonów w jądrze. Liczba masowa to suma protonów i neutronów w jądrze atomu. Oznacza to, że żeby obliczyć liczbę neutronów, trzeba od liczby masowej odjąć liczbę atomową.
Czyli:
- Liczba protonów = Liczba atomowa (Z)
- Liczba elektronów = Liczba protonów (w atomie obojętnym elektrycznie)
- Liczba neutronów = Liczba masowa (A) - Liczba atomowa (Z)
Przejdźmy teraz do układu okresowego pierwiastków. Układ okresowy to taka "tablica", w której wszystkie znane pierwiastki są uporządkowane według rosnącej liczby atomowej. Ale to nie tylko zwykła lista! Układ okresowy jest tak skonstruowany, żeby pokazywać pewne podobieństwa i trendy we właściwościach pierwiastków.
Pierwiastki są ułożone w grupy (kolumny) i okresy (rzędy). Pierwiastki w tej samej grupie mają podobne właściwości chemiczne. To dlatego, że mają taką samą liczbę elektronów na ostatniej powłoce, czyli elektronów walencyjnych. Elektrony walencyjne decydują o tym, jak pierwiastek będzie reagował z innymi pierwiastkami. Na przykład, pierwiastki z grupy 1 (litowce) mają jeden elektron walencyjny i są bardzo reaktywne. Pierwiastki z grupy 18 (helowce, gazy szlachetne) mają pełną powłokę walencyjną (z wyjątkiem helu, który ma tylko dwa elektrony na pierwszej powłoce) i są bardzo niereaktywne.
Okresy pokazują, ile powłok elektronowych ma dany pierwiastek. Na przykład, pierwiastki w pierwszym okresie (wodór i hel) mają tylko jedną powłokę elektronową. Pierwiastki w drugim okresie (lit, beryl, bor, węgiel, azot, tlen, fluor, neon) mają dwie powłoki elektronowe i tak dalej.
Układ okresowy można podzielić na kilka bloków, które odpowiadają typowi orbitali, na których znajdują się ostatnie elektrony danego pierwiastka. Mamy blok s (grupy 1 i 2), blok p (grupy 13-18), blok d (metale przejściowe) i blok f (lantanowce i aktynowce).
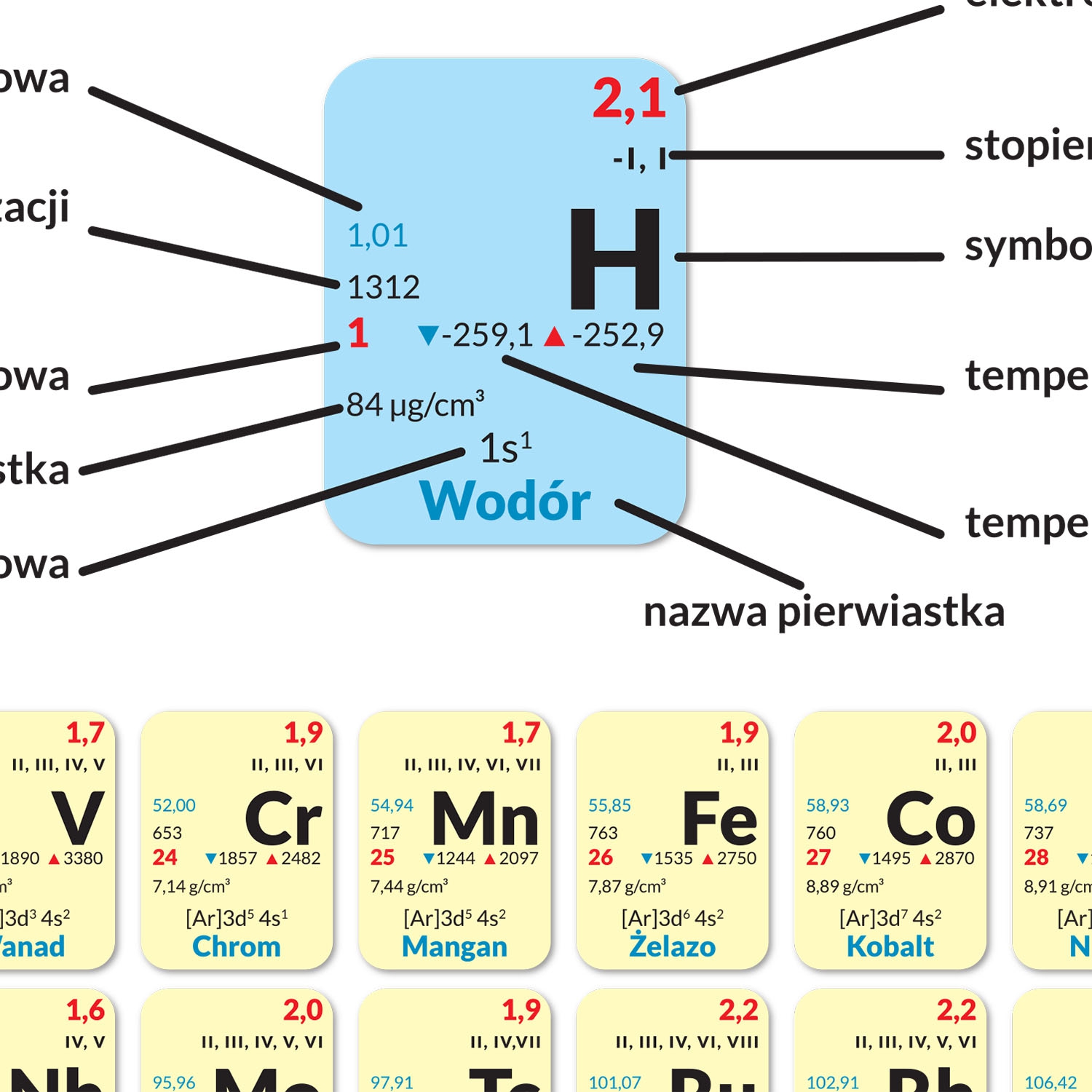
Konfiguracja elektronowa to zapis, który pokazuje, jak elektrony są rozmieszczone na poszczególnych powłokach i orbitalach w atomie. Na przykład, konfiguracja elektronowa sodu (Na, Z=11) to 1s² 2s² 2p⁶ 3s¹. Oznacza to, że sód ma 2 elektrony na orbitalu 1s, 2 elektrony na orbitalu 2s, 6 elektronów na orbitalu 2p i 1 elektron na orbitalu 3s. Znajomość konfiguracji elektronowej pozwala przewidzieć właściwości chemiczne danego pierwiastka.
Jak to wykorzystać na sprawdzianie?
Teraz trochę o tym, jak wykorzystać te informacje na sprawdzianie. Po pierwsze, upewnijcie się, że dobrze rozumiecie definicje wszystkich pojęć, o których mówiliśmy. Wiedza, co to jest proton, neutron, elektron, liczba atomowa, liczba masowa, konfiguracja elektronowa, grupa i okres w układzie okresowym, to podstawa.
Po drugie, spróbujcie rozwiązać jak najwięcej zadań. Im więcej zadań zrobicie, tym lepiej zrozumiecie, jak stosować te pojęcia w praktyce. Na przykład, spróbujcie obliczyć liczbę protonów, neutronów i elektronów w różnych atomach i jonach. Spróbujcie napisać konfiguracje elektronowe dla różnych pierwiastków. Spróbujcie przewidzieć właściwości chemiczne pierwiastków na podstawie ich położenia w układzie okresowym.
Po trzecie, nie panikujcie! Sprawdzian to tylko jeden test. Jeżeli czegoś nie wiecie, to spróbujcie to wydedukować. Często można dojść do poprawnej odpowiedzi, nawet jeśli nie jest się pewnym wszystkiego. Na przykład, jeżeli nie pamiętacie, jaka jest konfiguracja elektronowa danego pierwiastka, to spróbujcie ją napisać na podstawie jego położenia w układzie okresowym.
Pamiętajcie, że układ okresowy to nie tylko zbiór informacji, ale też narzędzie. Używajcie go podczas rozwiązywania zadań! Możecie z niego odczytać liczbę atomową danego pierwiastka, a także jego konfigurację elektronową (mniej więcej).
Kilka dodatkowych wskazówek
-
Zapamiętajcie symbole pierwiastków. Wiedza, że "H" to wodór, "O" to tlen, "Na" to sód, a "Cl" to chlor, bardzo ułatwia rozwiązywanie zadań.
-
Zrozumcie, jak tworzą się jony. Jon to atom, który stracił lub zyskał elektrony. Jeżeli atom stracił elektrony, to staje się jonem dodatnim (kationem). Jeżeli atom zyskał elektrony, to staje się jonem ujemnym (anionem). Liczba elektronów, które atom stracił lub zyskał, decyduje o ładunku jonu.
-
Nauczcie się określać liczbę elektronów walencyjnych. To bardzo ważne, ponieważ liczba elektronów walencyjnych decyduje o tym, jak pierwiastek będzie reagował z innymi pierwiastkami.
-
Ćwiczcie pisanie konfiguracji elektronowych. To może wydawać się trudne na początku, ale z czasem stanie się to automatyczne.
Mam nadzieję, że to wszystko Wam pomoże. Powodzenia na sprawdzianie! Pamiętajcie, że najważniejsze to zrozumieć, o co chodzi, a nie tylko nauczyć się na pamięć. Jeżeli macie jeszcze jakieś pytania, to śmiało pytajcie! Postaram się odpowiedzieć jak najlepiej potrafię. I nie zapomnijcie, chemia może być fascynująca!