Budowa Atomu Układ Okresowy Pierwiastków Chemicznych
Zanurzmy się w fascynujący świat budowy atomu i układu okresowego pierwiastków chemicznych!
Atomy, te mikroskopijne cegiełki, z których zbudowana jest cała materia we wszechświecie, stanowią podstawę wszystkiego, co nas otacza. Każdy atom składa się z jeszcze mniejszych cząstek subatomowych: protonów, neutronów i elektronów.
Protony, naładowane dodatnio, i neutrony, obojętne elektrycznie, znajdują się w jądrze atomowym, stanowiącym centralny punkt każdego atomu. Masa atomu skupiona jest właśnie w jądrze, ponieważ elektrony, choć równie istotne, posiadają znikomą masę w porównaniu do protonów i neutronów. Liczba protonów w jądrze decyduje o tym, jakim pierwiastkiem jest dany atom. Na przykład, każdy atom węgla ma sześć protonów w swoim jądrze. Zmiana tej liczby przekształca atom w inny pierwiastek.
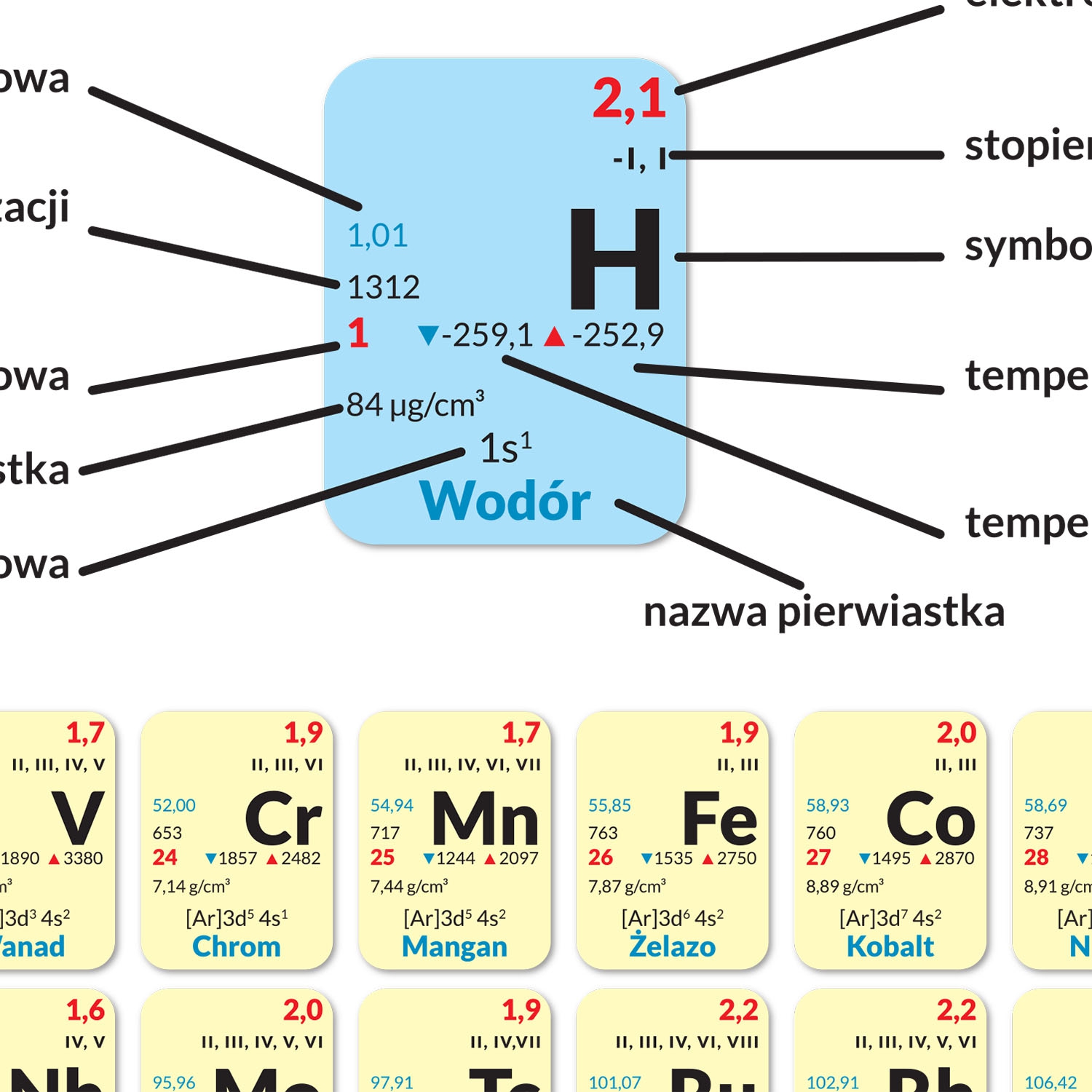
Elektrony, naładowane ujemnie, krążą wokół jądra atomowego w pewnych odległościach, tworząc tak zwane powłoki elektronowe. Liczba elektronów w atomie neutralnym jest równa liczbie protonów w jądrze. Elektrony nie krążą po określonych orbitach jak planety wokół słońca, lecz znajdują się w przestrzeni wokół jądra w obszarach o wysokim prawdopodobieństwie ich występowania, zwanych orbitalami.
Rozmieszczenie elektronów na powłokach elektronowych odgrywa kluczową rolę w określaniu właściwości chemicznych danego pierwiastka. Atomy dążą do osiągnięcia stabilnej konfiguracji elektronowej, czyli takiej, w której ich zewnętrzna powłoka elektronowa jest całkowicie zapełniona. Atomy mogą osiągnąć tę stabilność poprzez oddawanie, przyjmowanie lub współdzielenie elektronów z innymi atomami, tworząc wiązania chemiczne.
Układ Okresowy Pierwiastków: Mapa Świata Atomów
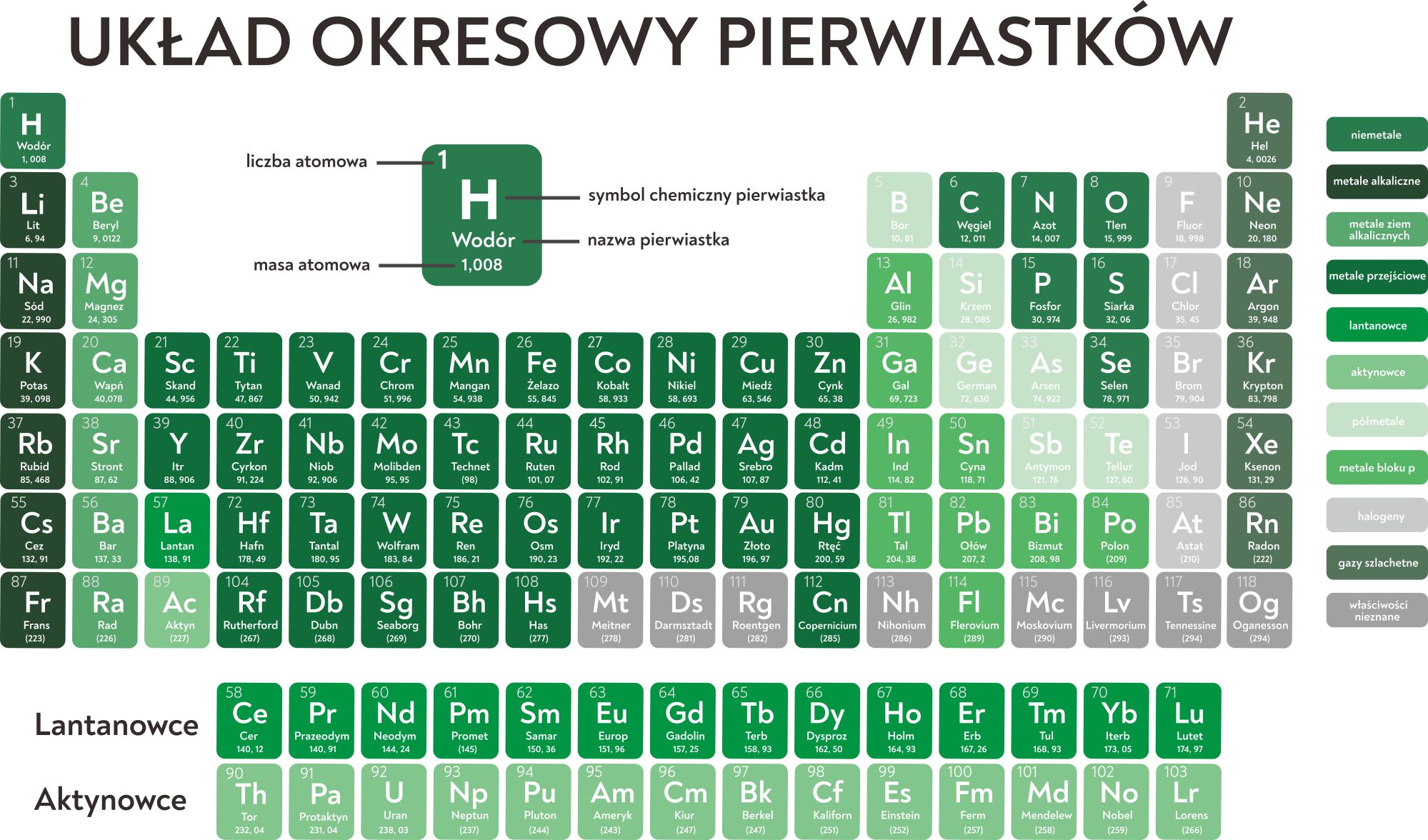
Układ okresowy pierwiastków, to genialne narzędzie, które porządkuje wszystkie znane pierwiastki w oparciu o ich właściwości chemiczne. Został on stworzony przez Dmitrija Mendelejewa w XIX wieku i od tego czasu był wielokrotnie udoskonalany. Układ okresowy nie tylko grupuje pierwiastki według ich podobieństw, ale także pozwala przewidywać właściwości nieznanych jeszcze pierwiastków.
Pierwiastki w układzie okresowym ułożone są w rzędy poziome, zwane okresami, oraz w kolumny pionowe, zwane grupami. Liczba atomowa, która odpowiada liczbie protonów w jądrze atomu, rośnie wraz z przemieszczaniem się od lewej do prawej strony w każdym okresie. Pierwiastki w tej samej grupie mają podobną konfigurację elektronową na zewnętrznej powłoce, co skutkuje podobnymi właściwościami chemicznymi.
Grupy w układzie okresowym posiadają często swoje nazwy. Na przykład, grupa 1 to litowce (z wyjątkiem wodoru), które są bardzo reaktywne chemicznie. Grupa 2 to berylowce, również reaktywne, ale mniej niż litowce. Grupa 17 to fluorowce, bardzo reaktywne niemetale, a grupa 18 to gazy szlachetne, które charakteryzują się wyjątkową obojętnością chemiczną.
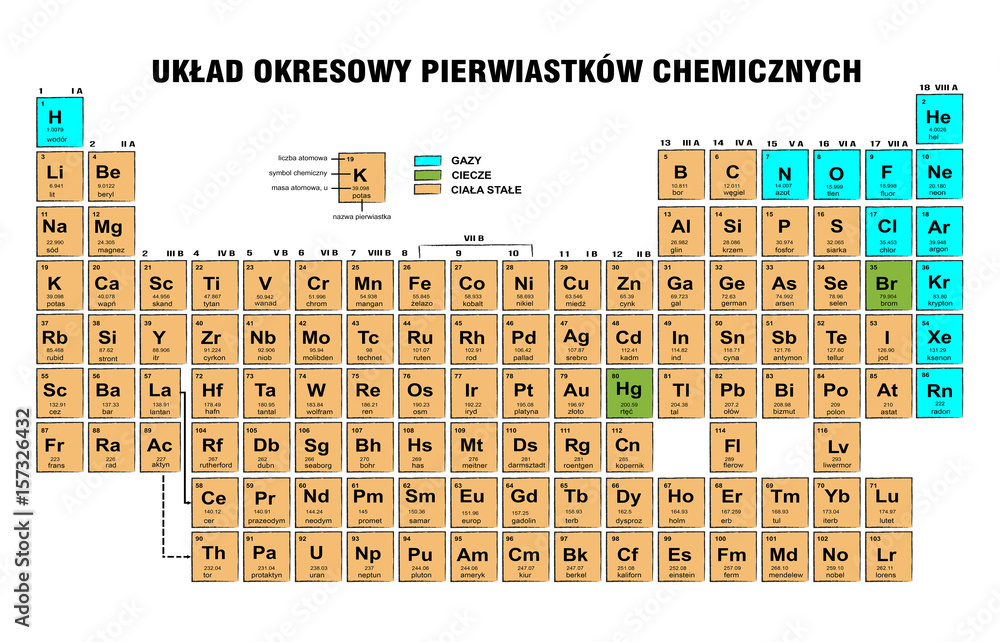
Przechodząc przez okres od lewej do prawej, obserwujemy stopniowe zmiany we właściwościach pierwiastków. Po lewej stronie układu okresowego znajdują się metale, które charakteryzują się dobrym przewodnictwem elektrycznym i cieplnym, a także połyskiem. Po prawej stronie znajdują się niemetale, które mają zazwyczaj przeciwne właściwości do metali. Pomiędzy metalami a niemetalami znajdują się półmetale, które posiadają właściwości pośrednie między metalami a niemetalami i są często wykorzystywane w elektronice.
Układ okresowy jest podzielony na bloki, które odzwierciedlają, który orbital atomowy jest ostatni wypełniany elektronami. Blok s (grupy 1 i 2) to pierwiastki, w których ostatni elektron znajduje się na orbitalu s. Blok p (grupy 13-18) to pierwiastki, w których ostatni elektron znajduje się na orbitalu p. Blok d (grupy 3-12) to metale przejściowe, w których ostatni elektron znajduje się na orbitalu d. Blok f to lantanowce i aktynowce, w których ostatni elektron znajduje się na orbitalu f.
Lantanowce i aktynowce, często nazywane metalami ziem rzadkich, znajdują się poza główną częścią układu okresowego, aby zachować jego zwartość. Lantanowce posiadają bardzo podobne właściwości chemiczne, co wynika z faktu, że ich elektrony walencyjne (czyli te biorące udział w tworzeniu wiązań chemicznych) znajdują się na wewnętrznych powłokach elektronowych. Aktynowce są radioaktywne, a niektóre z nich, na przykład uran i pluton, mają strategiczne znaczenie ze względu na ich wykorzystanie w energetyce jądrowej i broni jądrowej.
Warto zauważyć, że układ okresowy jest dynamiczny i wciąż się rozwija. Syntetyzuje się coraz to nowe pierwiastki, które są następnie dodawane do układu. Ich właściwości są dokładnie badane, co pozwala na lepsze zrozumienie fundamentalnych zasad chemii.
Układ okresowy jest nie tylko narzędziem dla chemików, ale także cennym źródłem informacji dla innych dziedzin nauki, takich jak fizyka, biologia, geologia i inżynieria materiałowa. Zrozumienie budowy atomu i układu okresowego jest kluczowe dla zrozumienia świata, w którym żyjemy. Bez tego zrozumienia nie byłoby możliwe opracowanie nowoczesnych technologii, leków i materiałów.
Zatem, eksplorujmy dalej ten fascynujący świat atomów i układu okresowego, aby odkryć jeszcze więcej tajemnic, które kryją się w strukturze materii!