Budowa Atomu Sprawdzian Nowa Era

Współczesna nauka zawdzięcza ogromny postęp zrozumieniu budowy atomu. Od prostych, intuicyjnych modeli po złożone, kwantowe opisy – ewolucja wiedzy o atomie jest fascynującą historią odkryć. Zrozumienie tej budowy jest fundamentalne dla wielu dziedzin, od chemii i fizyki po medycynę i inżynierię materiałową. Niniejszy artykuł ma na celu przedstawienie kluczowych aspektów budowy atomu, szczególnie w kontekście zagadnień, które mogą pojawić się na sprawdzianach z zakresu programu Nowej Ery, przy jednoczesnym zachowaniu precyzji i unikaniu nadmiernych uproszczeń.
Podstawowe składniki atomu
Atom składa się z trzech głównych rodzajów cząstek subatomowych: protonów, neutronów i elektronów. Protony i neutrony znajdują się w jądrze atomowym, które stanowi centralną i najcięższą część atomu. Elektrony krążą wokół jądra na określonych poziomach energetycznych zwanych orbitalami.
Protony i neutrony
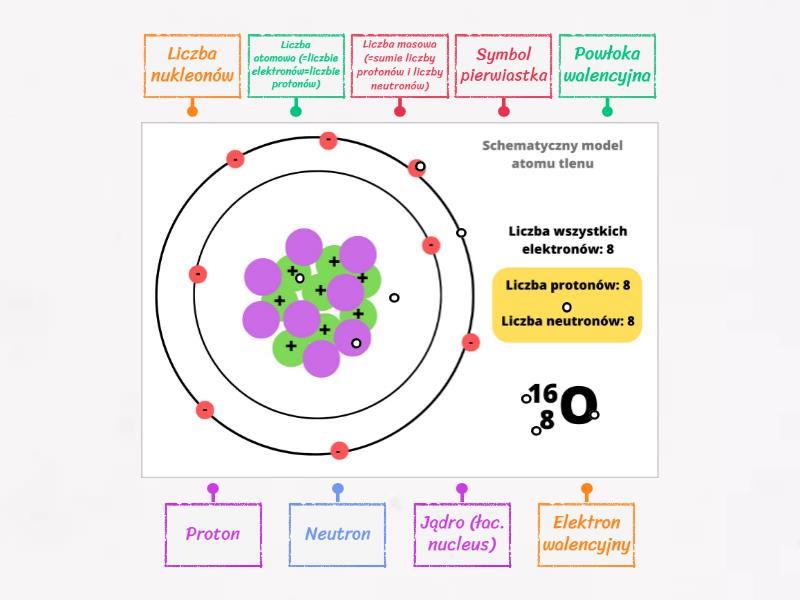
Protony posiadają ładunek dodatni (+1), a ich liczba w jądrze atomowym decyduje o tym, jaki pierwiastek chemiczny reprezentuje dany atom. Ta liczba to tzw. liczba atomowa (Z). Na przykład, atom wodoru (H) ma jeden proton w jądrze (Z=1), a atom węgla (C) ma sześć protonów (Z=6). Liczba neutronów w jądrze atomowym może być różna dla tego samego pierwiastka. Atomy tego samego pierwiastka, różniące się liczbą neutronów, nazywamy izotopami. Neutrony są elektrycznie obojętne i razem z protonami tworzą masę jądra atomowego.
Elektrony
Elektrony posiadają ładunek ujemny (-1) i są znacznie lżejsze od protonów i neutronów. Ich masa jest pomijalna w porównaniu z masą jądra. Elektrony krążą wokół jądra na ściśle określonych poziomach energetycznych, tworząc chmurę elektronową. Każdy poziom energetyczny może pomieścić ograniczoną liczbę elektronów. Rozmieszczenie elektronów na poszczególnych poziomach energetycznych nazywamy konfiguracją elektronową. Konfiguracja elektronowa decyduje o właściwościach chemicznych danego atomu, czyli o tym, jak atom będzie reagował z innymi atomami.
Liczba atomowa i liczba masowa
Liczba atomowa (Z), jak już wspomniano, określa liczbę protonów w jądrze atomowym i jednoznacznie identyfikuje dany pierwiastek. Na przykład, każdy atom, który ma osiem protonów w jądrze, jest atomem tlenu (O). Liczba masowa (A) określa sumę liczby protonów i neutronów w jądrze atomowym. Dla danego pierwiastka, liczba masowa może się różnić w zależności od izotopu.
Przykładowo, atom węgla-12 (12C) ma 6 protonów i 6 neutronów (Z=6, A=12), natomiast atom węgla-14 (14C) ma 6 protonów i 8 neutronów (Z=6, A=14). Oba są izotopami węgla, ale różnią się liczbą neutronów i co za tym idzie, właściwościami fizycznymi (np. promieniotwórczość 14C).
Orbitale atomowe i konfiguracja elektronowa
Elektrony nie krążą wokół jądra po ustalonych orbitach, jak sugerował model Bohra. Zamiast tego, poruszają się w obszarach przestrzeni wokół jądra, w których prawdopodobieństwo ich znalezienia jest największe. Te obszary przestrzeni nazywamy orbitalami atomowymi. Orbitale atomowe mają różne kształty i energie. Wyróżniamy cztery główne typy orbitali: s, p, d i f.
Typy orbitali
Orbital s ma kształt sferyczny. Każdy poziom energetyczny ma jeden orbital s. Orbital p ma kształt hantli. Każdy poziom energetyczny (począwszy od drugiego) ma trzy orbitale p, zorientowane w przestrzeni prostopadle do siebie. Orbitale d i f mają bardziej skomplikowane kształty i występują na wyższych poziomach energetycznych.
Zasady zapisu konfiguracji elektronowej
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na poszczególnych orbitalach atomowych. Zapis konfiguracji elektronowej opiera się na kilku zasadach:
- Zasada minimalnej energii (Aufbau): Elektrony zajmują orbitale o najniższej energii.
- Reguła Hunda: Elektrony umieszczane są pojedynczo na każdym orbitalu o tej samej energii, zanim zaczną tworzyć pary.
- Zakaz Pauliego: Na jednym orbitalu mogą znajdować się maksymalnie dwa elektrony, ale muszą mieć przeciwne spiny.
Przykładowo, konfiguracja elektronowa atomu wodoru (H) to 1s1, co oznacza, że jeden elektron znajduje się na orbitalu s pierwszego poziomu energetycznego. Konfiguracja elektronowa atomu tlenu (O) to 1s22s22p4, co oznacza, że dwa elektrony znajdują się na orbitalu s pierwszego poziomu, dwa elektrony na orbitalu s drugiego poziomu i cztery elektrony na orbitalach p drugiego poziomu.
Jony
Atom w stanie obojętnym elektrycznie ma tyle samo protonów co elektronów. Jednak atom może tracić lub przyjmować elektrony, tworząc jony. Atom, który stracił elektrony, staje się jonem dodatnim, zwanym kationem. Atom, który przyjął elektrony, staje się jonem ujemnym, zwanym anionem.
Na przykład, atom sodu (Na) łatwo traci jeden elektron, tworząc jon Na+, który ma ładunek dodatni +1. Atom chloru (Cl) łatwo przyjmuje jeden elektron, tworząc jon Cl-, który ma ładunek ujemny -1. Tworzenie jonów jest kluczowe dla powstawania wiązań chemicznych i tworzenia związków chemicznych.
Izotopy i ich zastosowania
Jak już wspomniano, izotopy to atomy tego samego pierwiastka, które różnią się liczbą neutronów w jądrze. Niektóre izotopy są stabilne, a inne są promieniotwórcze. Izotopy promieniotwórcze emitują promieniowanie, które może być wykorzystywane w różnych dziedzinach, takich jak medycyna, archeologia i przemysł.
Przykłady zastosowań izotopów:
- Medycyna: Izotop jodu-131 (131I) jest stosowany w leczeniu chorób tarczycy. Izotop technetu-99m (99mTc) jest stosowany w diagnostyce obrazowej, np. w scyntygrafii.
- Archeologia: Izotop węgla-14 (14C) jest stosowany do datowania znalezisk archeologicznych, np. kości, drewna i tkanin.
- Przemysł: Izotopy promieniotwórcze są stosowane do pomiaru grubości materiałów, do wykrywania nieszczelności w rurociągach i do sterylizacji sprzętu medycznego.
Modele atomu: ewolucja wiedzy
Zrozumienie budowy atomu ewoluowało na przestrzeni lat. Od prostych modeli, takich jak model Daltona, który zakładał, że atom jest niepodzielną kulą, po bardziej zaawansowane modele, takie jak model Bohra i model kwantowo-mechaniczny.
Model Daltona
Model Daltona był pierwszym naukowym modelem atomu. Dalton zakładał, że wszystkie atomy danego pierwiastka są identyczne i mają taką samą masę. Model Daltona nie uwzględniał istnienia cząstek subatomowych.
Model Thomsona
Model Thomsona, zwany również modelem "ciasta z rodzynkami", zakładał, że atom jest kulą o dodatnim ładunku, w której zanurzone są elektrony o ładunku ujemnym. Model Thomsona uwzględniał istnienie elektronów, ale nie uwzględniał jądra atomowego.
Model Rutherforda
Model Rutherforda, oparty na eksperymencie z rozpraszaniem cząstek alfa na złotej folii, wykazał, że atom ma małe, gęste jądro o ładunku dodatnim, wokół którego krążą elektrony. Model Rutherforda był rewolucyjny, ponieważ wprowadził pojęcie jądra atomowego.
Model Bohra
Model Bohra wprowadził pojęcie kwantyzacji energii elektronów. Bohr zakładał, że elektrony krążą wokół jądra po ściśle określonych orbitach o określonej energii. Model Bohra wyjaśniał widmo emisyjne wodoru, ale nie był w stanie wyjaśnić widm emisyjnych bardziej złożonych atomów.
Model kwantowo-mechaniczny
Model kwantowo-mechaniczny jest najbardziej zaawansowanym modelem atomu. Model ten opisuje elektrony jako fale i uwzględnia ich nieoznaczoność położenia i pędu. Model kwantowo-mechaniczny jest najbardziej precyzyjny i jest szeroko stosowany w chemii i fizyce.
Podsumowanie
Zrozumienie budowy atomu jest kluczowe dla zrozumienia wielu zjawisk chemicznych i fizycznych. Od składu atomu, przez konfigurację elektronową, po izotopy i modele atomu – wszystkie te aspekty są istotne dla pełnego zrozumienia tematu. Przygotowując się do sprawdzianu z chemii lub fizyki, warto zwrócić szczególną uwagę na omówione zagadnienia i upewnić się, że rozumiesz podstawowe pojęcia i zasady. Pamiętaj, że nauka o atomie to ciągły proces odkrywania, a zrozumienie podstaw otwiera drzwi do dalszych, fascynujących odkryć.
Zachęcam do dalszego zgłębiania wiedzy z zakresu budowy atomu! Wykorzystaj dostępne materiały edukacyjne, eksperymenty wirtualne i zadawaj pytania, aby poszerzyć swoje horyzonty i osiągnąć sukces na sprawdzianie!