Budowa Atomu Pierwiastka A Jego Położenie W Układzie Okresowym
Atom, to najmniejsza część pierwiastka chemicznego zachowująca jego właściwości. Zrozumienie jego budowy jest kluczowe do poznania chemii. Zasadniczo, atom składa się z trzech rodzajów cząstek elementarnych: protonów, neutronów i elektronów.
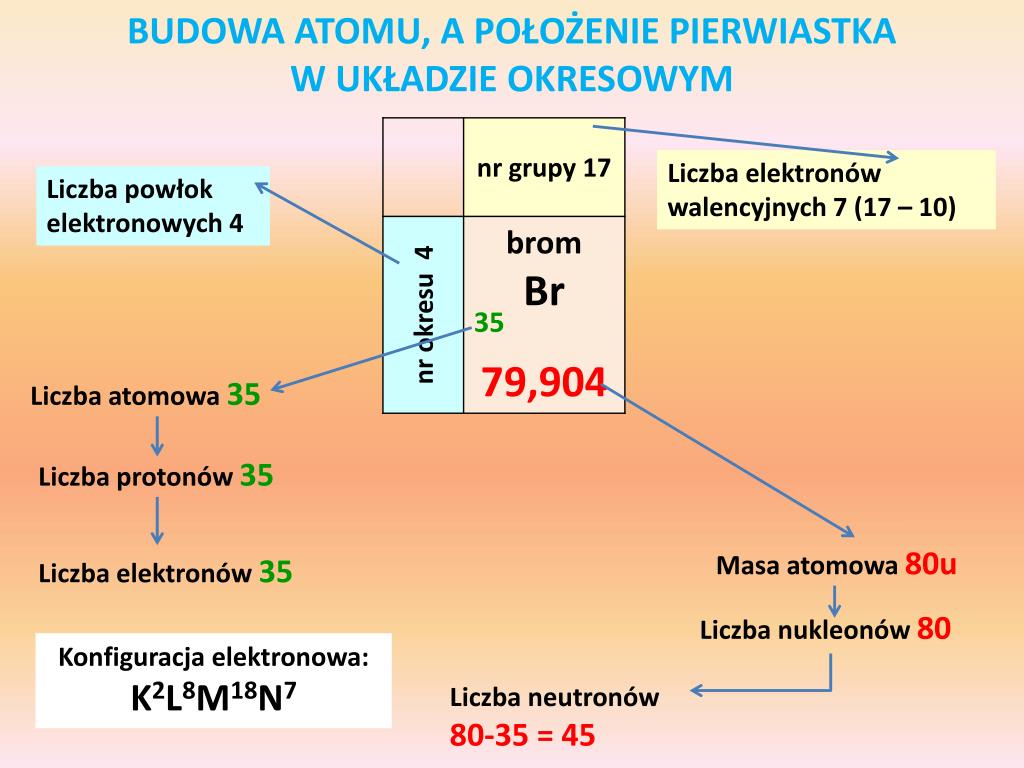
Protony i neutrony znajdują się w centralnej części atomu, tworząc jądro atomowe. Protony mają ładunek dodatni, a neutrony są elektrycznie obojętne. Liczba protonów w jądrze decyduje o tym, jakim pierwiastkiem chemicznym jest dany atom. Ta liczba nazywana jest liczbą atomową (symbol Z) i to ona identyfikuje dany pierwiastek w układzie okresowym. Na przykład, każdy atom węgla ma 6 protonów w jądrze (Z=6). Zmiana liczby protonów zmienia pierwiastek.
Elektrony, z kolei, posiadają ładunek ujemny i krążą wokół jądra atomowego w pewnej odległości. Nie poruszają się po zdefiniowanych orbitach, jak planety wokół Słońca, ale raczej zajmują obszary wokół jądra zwane orbitalami atomowymi. Orbital atomowy to obszar, w którym prawdopodobieństwo znalezienia elektronu jest największe. Elektrony są rozmieszczone na różnych poziomach energetycznych, zwanych powłokami elektronowymi. Powłoki te są numerowane od 1 (najbliższa jądra) do nieskończoności, chociaż w praktyce znamy atomy, których elektrony zajmują tylko kilka pierwszych powłok.
Liczba elektronów w neutralnym atomie jest równa liczbie protonów w jądrze. Dzięki temu atom jako całość jest elektrycznie obojętny. Jednak atom może tracić lub zyskiwać elektrony, tworząc jony. Jon, który stracił elektrony, ma ładunek dodatni i nazywany jest kationem. Jon, który zyskał elektrony, ma ładunek ujemny i nazywany jest anionem.
Izotopy to atomy tego samego pierwiastka, które mają różną liczbę neutronów w jądrze. Oznacza to, że mają tę samą liczbę protonów (i tę samą liczbę atomową), ale różną liczbę masową (A). Liczba masowa to suma liczby protonów i neutronów w jądrze atomowym. Na przykład, węgiel-12 (¹²C) i węgiel-14 (¹⁴C) to izotopy węgla. Oba mają 6 protonów, ale węgiel-12 ma 6 neutronów, a węgiel-14 ma 8 neutronów. Izotopy danego pierwiastka mają bardzo podobne właściwości chemiczne, ale różnią się właściwościami fizycznymi, takimi jak masa. Niektóre izotopy są radioaktywne, co oznacza, że ich jądra są niestabilne i ulegają rozpadowi, emitując cząstki lub promieniowanie.
Układ okresowy pierwiastków to fundamentalne narzędzie w chemii, które organizuje pierwiastki chemiczne według ich liczby atomowej (Z) i konfiguracji elektronowej. Układ okresowy dostarcza mnóstwo informacji o właściwościach pierwiastków i ich związków.
Położenie Pierwiastka w Układzie Okresowym
Położenie pierwiastka w układzie okresowym jest ściśle związane z jego budową atomową. Układ okresowy jest podzielony na okresy (rzędy poziome) i grupy (kolumny pionowe).
Numer okresu odpowiada liczbie powłok elektronowych, które są zajęte przez elektrony w atomie danego pierwiastka. Na przykład, pierwiastki w 3. okresie mają elektrony na 3 powłokach elektronowych. Pierwiastki w tym samym okresie różnią się liczbą protonów i elektronów, a ich właściwości zmieniają się stopniowo wraz ze wzrostem liczby atomowej.
Numer grupy (zazwyczaj oznaczany cyframi rzymskimi lub arabskimi) wskazuje na liczbę elektronów walencyjnych, czyli elektronów znajdujących się na ostatniej powłoce elektronowej. Elektrony walencyjne decydują o właściwościach chemicznych pierwiastka i jego zdolności do tworzenia wiązań chemicznych z innymi atomami. Pierwiastki w tej samej grupie mają podobne właściwości chemiczne, ponieważ mają tę samą liczbę elektronów walencyjnych. Wyjątkiem jest hel, który pomimo posiadania 2 elektronów walencyjnych, jest gazem szlachetnym i ma właściwości podobne do innych gazów szlachetnych (grupa 18).
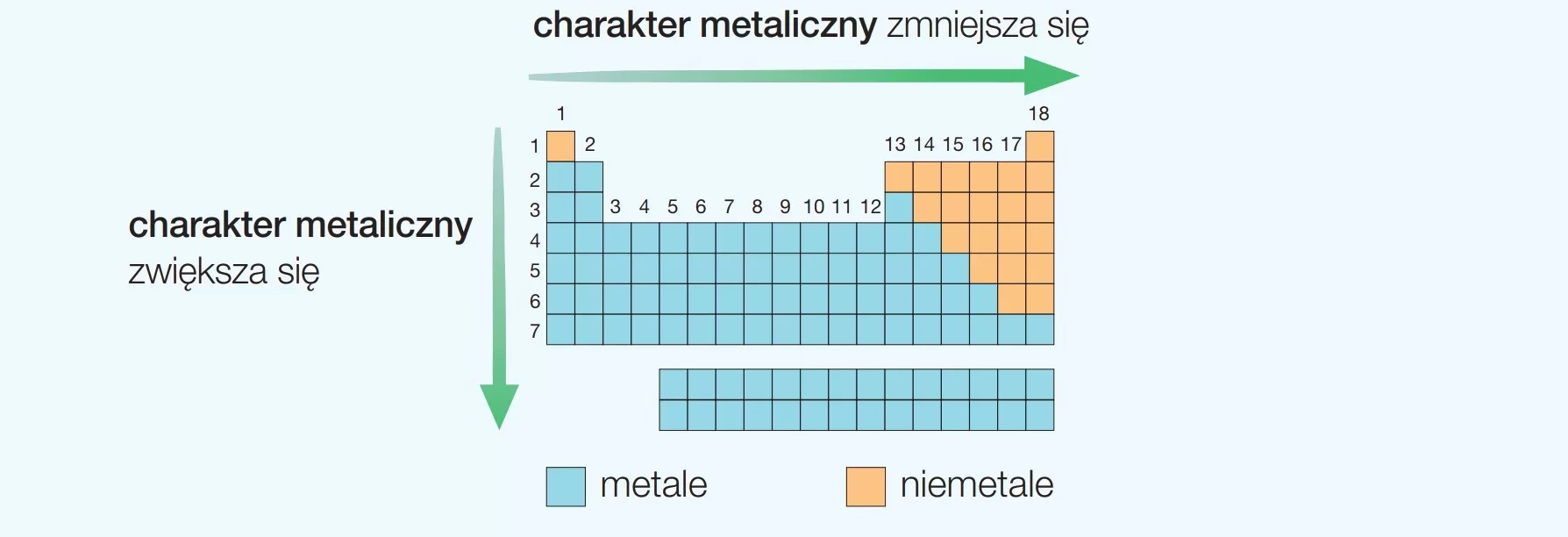
Grupy 1 i 2 (metale alkaliczne i metale ziem alkalicznych) charakteryzują się wysoką reaktywnością chemiczną, ponieważ łatwo tracą odpowiednio 1 i 2 elektrony walencyjne, tworząc kationy. Grupy od 13 do 17 zawierają pierwiastki o zróżnicowanych właściwościach, od metali przez metaloidy (półmetale) po niemetale. Grupa 18 to gazy szlachetne, które charakteryzują się bardzo niską reaktywnością chemiczną, ponieważ mają pełną ostatnią powłokę elektronową (8 elektronów walencyjnych, z wyjątkiem helu, który ma 2).
Pomiędzy grupami 2 i 13 znajdują się metale przejściowe, które charakteryzują się obecnością elektronów na powłoce (n-1)d. Metale przejściowe mają zmienne stopnie utlenienia i tworzą barwne związki. Na dole układu okresowego znajdują się lantanowce i aktynowce, które są wydzielone, aby układ okresowy był bardziej czytelny.
Konfiguracja elektronowa pierwiastka to opis rozmieszczenia elektronów na poszczególnych powłokach i orbitalach atomowych. Konfiguracja elektronowa wpływa na właściwości chemiczne pierwiastka i jego położenie w układzie okresowym. Można ją przewidzieć na podstawie liczby atomowej i zasady Aufbaua, która mówi, że elektrony zajmują najpierw orbitale o najniższej energii. Istnieją jednak pewne wyjątki od tej zasady, zwłaszcza w przypadku metali przejściowych.
Zrozumienie budowy atomu i związku między budową atomową a położeniem pierwiastka w układzie okresowym jest fundamentalne dla zrozumienia chemii. Układ okresowy jest potężnym narzędziem, które pozwala przewidywać właściwości pierwiastków i ich związków.
Dzięki analizie położenia pierwiastka w układzie okresowym, można wnioskować o jego liczbie atomowej, liczbie elektronów walencyjnych, konfiguracji elektronowej, a także o jego właściwościach chemicznych, takich jak reaktywność, charakter metaliczny lub niemetaliczny oraz zdolność do tworzenia wiązań chemicznych. Wiedza ta jest niezbędna w wielu dziedzinach nauki i technologii, od chemii i fizyki po biologię i inżynierię materiałową.