Budowa Atomu Nukleony I Elektrony
Czy kiedykolwiek zastanawiałeś się, z czego tak naprawdę zbudowana jest materia, która nas otacza? Od powietrza, którym oddychamy, po telefon, który trzymasz w ręce – wszystko składa się z niezwykle małych cząstek zwanych atomami. Ten artykuł ma na celu przybliżenie Ci budowy atomu, skupiając się na jego kluczowych elementach: nukleonach i elektronach. Stworzony został z myślą o osobach, które dopiero zaczynają swoją przygodę z chemią i fizyką, lub chcą odświeżyć swoją wiedzę na ten temat. Postaramy się wyjaśnić te zagadnienia w sposób przystępny i zrozumiały, unikając skomplikowanego języka naukowego.
Atom: Podstawowy Blok Materii
Atom to najmniejsza cząstka pierwiastka chemicznego, która zachowuje jego właściwości. Wyobraź sobie, że masz kawałek złota. Gdybyś mógł podzielić go na coraz mniejsze i mniejsze kawałki, w końcu dotarłbyś do atomu złota. Dalszy podział tego atomu nie zachowałby już właściwości złota.
Atom składa się z dwóch głównych obszarów:
- Jądro atomowe: Centralna część atomu, zawierająca nukleony.
- Powłoki elektronowe: Przestrzeń wokół jądra, gdzie znajdują się elektrony.
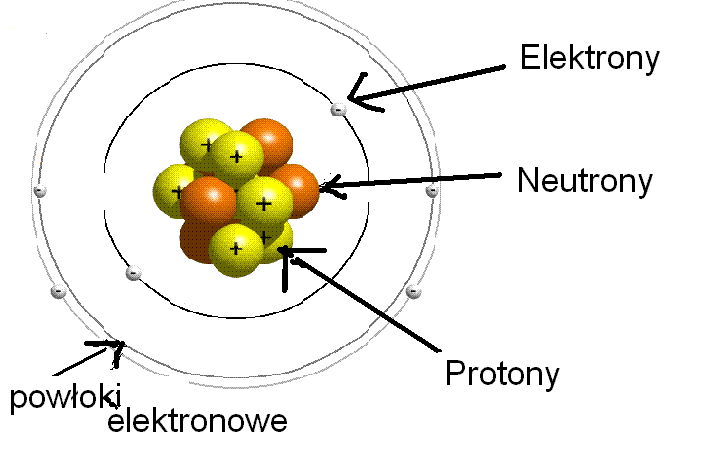
Nukleony: Mieszkańcy Jądra Atomowego
Jądro atomowe to serce atomu, a w nim znajdują się nukleony. Istnieją dwa rodzaje nukleonów:
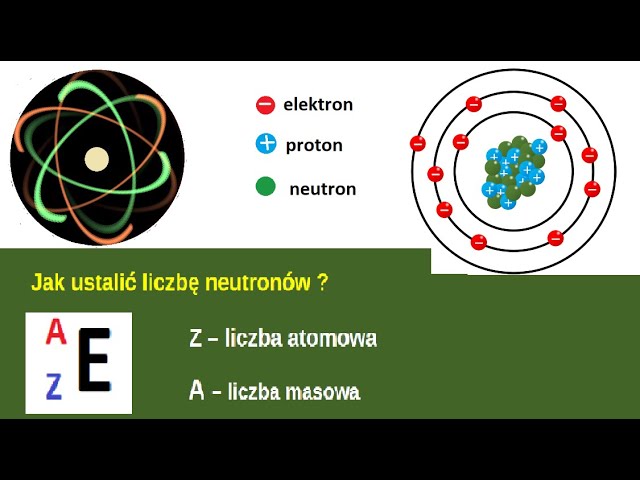
- Protony: Cząstki o ładunku dodatnim (+1). Liczba protonów w jądrze atomowym decyduje o tym, jaki to pierwiastek. Na przykład, każdy atom, który ma jeden proton, to atom wodoru. Liczbę protonów nazywamy liczbą atomową (oznaczaną literą Z).
- Neutrony: Cząstki obojętne elektrycznie (ładunek 0). Neutrony pomagają stabilizować jądro atomowe.
Liczba Masowa: Suma Protonów i Neutronów
Suma liczby protonów i neutronów w jądrze atomowym nazywana jest liczbą masową (oznaczaną literą A). Różne atomy tego samego pierwiastka mogą mieć różną liczbę neutronów. Takie atomy nazywamy izotopami.
Na przykład, wodór (Z=1) ma trzy znane izotopy:
- Prot (1H): Jeden proton i brak neutronów (A=1)
- Deuter (2H): Jeden proton i jeden neutron (A=2)
- Tryt (3H): Jeden proton i dwa neutrony (A=3)
Izotopy mają te same właściwości chemiczne, ale różne właściwości fizyczne ze względu na różną masę.
Elektrony: Krążące Wokół Jądra
Elektrony to cząstki o ładunku ujemnym (-1), które krążą wokół jądra atomowego. Znajdują się one na powłokach elektronowych (zwanych również orbitalami) o określonej energii. Im bliżej powłoka znajduje się jądra, tym niższa jest jej energia.
Konfiguracja Elektronowa: Rozmieszczenie Elektronów
Sposób rozmieszczenia elektronów na powłokach nazywany jest konfiguracją elektronową. Elektrony "wypełniają" powłoki elektronowe od tych o najniższej energii do tych o najwyższej. Liczba elektronów na danej powłoce jest ograniczona. Na przykład:
- Pierwsza powłoka (K) może pomieścić maksymalnie 2 elektrony.
- Druga powłoka (L) może pomieścić maksymalnie 8 elektronów.
- Trzecia powłoka (M) może pomieścić maksymalnie 18 elektronów (choć często spotyka się konfiguracje, gdzie jest 8 elektronów).
Konfiguracja elektronowa determinuje właściwości chemiczne atomu, ponieważ elektrony na zewnętrznej powłoce (zwanej powłoką walencyjną) biorą udział w tworzeniu wiązań chemicznych.
Ładunek Elektryczny Atomu
W normalnych warunkach, atom jest elektrycznie obojętny. Oznacza to, że liczba protonów (ładunek dodatni) jest równa liczbie elektronów (ładunek ujemny). Jeśli atom traci lub zyskuje elektrony, staje się jonem.
- Kation: Jon o ładunku dodatnim (utracił elektrony).
- Anion: Jon o ładunku ujemnym (zyskał elektrony).
Wiązania Chemiczne: Łączenie Atomów
Atomy łączą się ze sobą, tworząc cząsteczki i związki chemiczne. Wiązania chemiczne powstają w wyniku oddziaływań między elektronami walencyjnymi atomów. Istnieją różne rodzaje wiązań chemicznych, takie jak:
- Wiązanie kowalencyjne: Powstaje przez uwspólnienie elektronów między atomami.
- Wiązanie jonowe: Powstaje przez przekazanie elektronów od jednego atomu do drugiego, tworząc jony, które przyciągają się elektrostatycznie.
- Wiązanie metaliczne: Powstaje w metalach, gdzie elektrony walencyjne są delokalizowane i tworzą "morze elektronowe".
Rodzaj wiązania chemicznego determinuje właściwości fizyczne i chemiczne związku.
Model Atomu: Ewolucja Rozumienia
Nasze rozumienie budowy atomu ewoluowało na przestrzeni lat dzięki pracy wielu naukowców. Początkowo dominował model atomu Thomsona (zwany "ciastem z rodzynkami"), który zakładał, że atom to kula naładowana dodatnio, w której tkwią elektrony.
Następnie Ernest Rutherford przeprowadził słynny eksperyment z rozpraszaniem cząstek alfa na złotej folii, który doprowadził go do wniosku, że atom posiada małe, gęste jądro naładowane dodatnio. Rutherford zaproponował model planetarny atomu, w którym elektrony krążą wokół jądra jak planety wokół słońca.
Jednak model Rutherforda miał wady. Zgodnie z prawami fizyki klasycznej, krążące elektrony powinny tracić energię i ostatecznie spaść na jądro. Problem ten rozwiązał Niels Bohr, wprowadzając model atomu Bohra, w którym elektrony mogą krążyć tylko po określonych, dozwolonych orbitach o określonej energii. Elektrony mogą przeskakiwać między orbitami, emitując lub absorbując kwanty energii (fotony).
Współczesny model atomu opiera się na mechanice kwantowej i uwzględnia dualną naturę elektronów (cząsteczka i fala). Elektrony nie krążą po ściśle określonych orbitach, ale znajdują się w obszarach prawdopodobnego występowania, zwanych orbitalami atomowymi. Kształt orbitali atomowych jest skomplikowany i zależy od energii elektronu.
Podsumowanie: Budowa Atomu w Pigułce
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć podstawowe elementy budowy atomu: nukleony (protony i neutrony) oraz elektrony. Pamiętaj, że:
- Atom to podstawowy blok materii.
- Jądro atomowe zawiera protony (ładunek dodatni) i neutrony (ładunek obojętny).
- Liczba atomowa (Z) to liczba protonów w jądrze i decyduje o tym, jaki to pierwiastek.
- Liczba masowa (A) to suma liczby protonów i neutronów w jądrze.
- Elektrony (ładunek ujemny) krążą wokół jądra na powłokach elektronowych.
- Konfiguracja elektronowa determinuje właściwości chemiczne atomu.
Zrozumienie budowy atomu jest fundamentalne dla zrozumienia chemii i fizyki. Daje nam narzędzia do poznawania właściwości materii i przewidywania jej zachowania. Mam nadzieję, że ta wiedza okaże się dla Ciebie przydatna w dalszej edukacji i pozwoli spojrzeć na świat w bardziej świadomy sposób.
Dzięki za przeczytanie! Zachęcamy do dalszego zgłębiania wiedzy na temat fascynującego świata atomów!

![Budowa Atomu Nukleony I Elektrony Chemia klasa 7 [Lekcja 16 - Budowa atomu - nukleony i elektrony] - YouTube](https://i.ytimg.com/vi/not4NAhSezg/maxresdefault.jpg)




