Budowa Atomu I Konfiguracja Elektronowa
Hej Studenci! Przygotowujecie się do egzaminu z Budowy Atomu i Konfiguracji Elektronowej? Super! Wiem, że ten temat może wydawać się skomplikowany, ale spokojnie, rozłożymy go na czynniki pierwsze. Pamiętajcie, kluczem jest zrozumienie podstaw, a reszta pójdzie gładko. Powodzenia!
Podstawowe Składniki Atomu
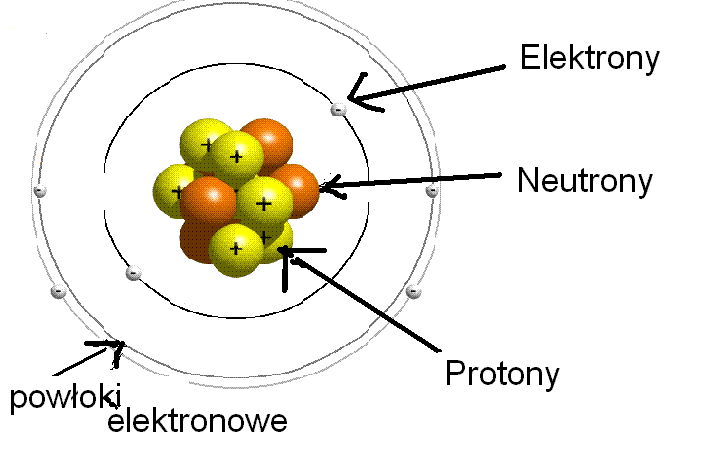
Zacznijmy od absolutnych podstaw. Atom to podstawowy element materii, a składa się z trzech głównych subcząstek:
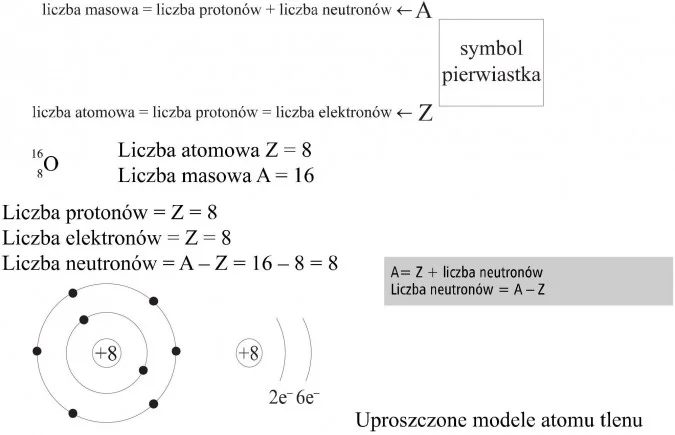
- Protony: Znajdują się w jądrze atomowym i mają ładunek dodatni (+1). Liczba protonów określa, jaki to pierwiastek. Ta liczba to tzw. liczba atomowa (Z).
- Neutrony: Również znajdują się w jądrze atomowym, ale są elektrycznie obojętne (ładunek 0). Razem z protonami tworzą masę atomową.
- Elektrony: Krążą wokół jądra atomowego i mają ładunek ujemny (-1). Decydują o właściwościach chemicznych atomu i jego zdolności do tworzenia wiązań.
Wyobraźcie sobie atom jako mały układ słoneczny. Jądro to Słońce (ciężkie i w centrum), a elektrony to planety krążące wokół niego. Oczywiście, to tylko analogia, ale pomaga w wizualizacji.
Jądro Atomowe
Jądro atomowe, jak już wiemy, zawiera protony i neutrony. Siły jądrowe, bardzo silne oddziaływania, utrzymują te cząstki razem, pokonując odpychanie elektrostatyczne między protonami. Liczba masowa (A) to suma protonów i neutronów w jądrze atomowym. Możemy ją obliczyć jako: A = Z + N, gdzie N to liczba neutronów.
Izotopy: Bardzo ważne! Izotopy to atomy tego samego pierwiastka (czyli mają tę samą liczbę protonów – Z), ale różnią się liczbą neutronów (N), a więc i liczbą masową (A). Na przykład, węgiel-12 (12C) i węgiel-14 (14C) to izotopy węgla. Mają po 6 protonów, ale węgiel-12 ma 6 neutronów, a węgiel-14 ma 8 neutronów.
Konfiguracja Elektronowa
Teraz przechodzimy do sedna – konfiguracji elektronowej. Konfiguracja elektronowa opisuje, jak elektrony są rozmieszczone wokół jądra atomowego. To rozmieszczenie decyduje o właściwościach chemicznych pierwiastka.
Orbitale Atomowe i Powłoki Elektronowe
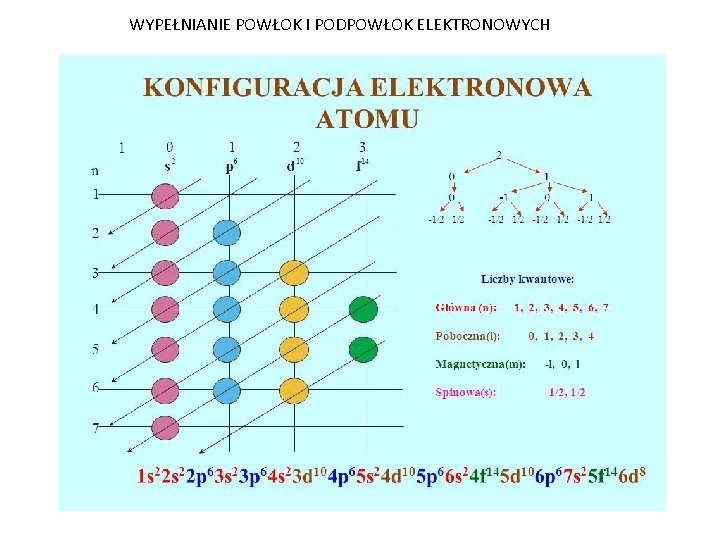
Elektrony nie krążą wokół jądra po prostu w dowolny sposób. Zajmują określone obszary przestrzeni nazywane orbitalami atomowymi. Orbitale atomowe grupuje się w powłoki elektronowe (oznaczane liczbami 1, 2, 3, itd. lub literami K, L, M, itd.). Im wyższa liczba powłoki, tym dalej od jądra i tym wyższa energia elektronu.
Każda powłoka może pomieścić określoną liczbę elektronów. Pierwsza powłoka (K) może pomieścić maksymalnie 2 elektrony, druga (L) – 8, trzecia (M) – 18, i tak dalej. Można to obliczyć ze wzoru 2n2, gdzie n to numer powłoki.
Rodzaje Orbitali
W obrębie każdej powłoki występują różne rodzaje orbitali, oznaczone literami s, p, d, i f. Mają one różne kształty i energie:
- Orbitale s: Mają kształt sferyczny. Każda powłoka ma jeden orbital s. Może pomieścić maksymalnie 2 elektrony.
- Orbitale p: Mają kształt hantli. Od drugiej powłoki wzwyż występują 3 orbitale p, zorientowane w przestrzeni wzdłuż osi x, y i z. Mogą pomieścić maksymalnie 6 elektronów (3 orbitale x 2 elektrony).
- Orbitale d: Bardziej skomplikowane kształty. Od trzeciej powłoki wzwyż występują 5 orbitali d. Mogą pomieścić maksymalnie 10 elektronów.
- Orbitale f: Jeszcze bardziej skomplikowane kształty. Od czwartej powłoki wzwyż występują 7 orbitali f. Mogą pomieścić maksymalnie 14 elektronów.
Zapis Konfiguracji Elektronowej
Konfigurację elektronową zapisujemy, podając numer powłoki, rodzaj orbitalu i liczbę elektronów na tym orbitalu. Na przykład:
- Wodór (H): 1s1 (jeden elektron na orbitalu s pierwszej powłoki)
- Hel (He): 1s2 (dwa elektrony na orbitalu s pierwszej powłoki)
- Lit (Li): 1s2 2s1 (dwa elektrony na orbitalu s pierwszej powłoki i jeden elektron na orbitalu s drugiej powłoki)
- Tlen (O): 1s2 2s2 2p4 (dwa elektrony na orbitalu s pierwszej powłoki, dwa elektrony na orbitalu s drugiej powłoki i cztery elektrony na orbitalach p drugiej powłoki)
Reguły Wypełniania Orbitali
Elektrony wypełniają orbitale zgodnie z pewnymi regułami:
- Zasada Aufbau (Reguła budowy): Elektrony zajmują orbitale o najniższej energii, zanim zaczną zajmować orbitale o wyższej energii. Kolejność wypełniania orbitali jest następująca: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Reguła Hunda: Elektrony, jeśli to możliwe, zajmują oddzielnie orbitale o tej samej energii (np. orbitale p), zanim zaczną łączyć się w pary na tym samym orbitalu. To wynika z faktu, że elektrony o tym samym spinie (orientacji pola magnetycznego) odpychają się.
- Zakaz Pauliego: Każdy orbital atomowy może pomieścić maksymalnie dwa elektrony, a te elektrony muszą mieć przeciwne spiny (spin +1/2 i -1/2).
Konfiguracja Elektronowa Skrócona
Zamiast pisać pełną konfigurację elektronową, można użyć konfiguracji skróconej. W tym przypadku, konfigurację elektronową najbliższego gazu szlachetnego (He, Ne, Ar, Kr, Xe, Rn) zapisujemy w nawiasie kwadratowym, a następnie dopisujemy konfigurację elektronową dla pozostałych elektronów. Na przykład:
- Sód (Na): [Ne] 3s1 (Ne = 1s2 2s2 2p6)
- Chlor (Cl): [Ne] 3s2 3p5
Elektrony Walencyjne
Elektrony walencyjne to elektrony znajdujące się na ostatniej, najbardziej zewnętrznej powłoce elektronowej atomu. To one decydują o właściwościach chemicznych pierwiastka i jego zdolności do tworzenia wiązań chemicznych. Atomy dążą do uzyskania stabilnej konfiguracji elektronowej, podobnej do gazów szlachetnych (8 elektronów walencyjnych – oktet elektronowy, lub 2 elektrony dla helu – dublet elektronowy). To dążenie prowadzi do tworzenia wiązań chemicznych.
Podsumowanie i Wskazówki
Pamiętajcie o najważniejszych rzeczach:
- Atom składa się z protonów, neutronów i elektronów.
- Liczba atomowa (Z) to liczba protonów.
- Liczba masowa (A) to suma protonów i neutronów.
- Konfiguracja elektronowa opisuje rozmieszczenie elektronów wokół jądra.
- Elektrony zajmują orbitale atomowe, które grupują się w powłoki elektronowe.
- Pamiętajcie o zasadzie Aufbau, regule Hunda i zakazie Pauliego.
- Elektrony walencyjne decydują o właściwościach chemicznych.
Wskazówki do nauki:
- Róbcie dużo zadań! Ćwiczenie czyni mistrza.
- Używajcie tablicy Mendelejewa – to wasz przyjaciel.
- Spróbujcie wizualizować sobie strukturę atomu – to pomaga zrozumieć, jak wszystko działa.
- Nie bójcie się pytać! Jeśli coś jest niejasne, zapytajcie nauczyciela, kolegę, albo poszukajcie odpowiedzi online.
Trzymam za was kciuki! Wierzę w was. Dasz radę! Powodzenia na egzaminie!