Budowa Atomu Chemia Rozszerzona Zadania

Chemia rozszerzona to fascynująca dziedzina, która pozwala nam zagłębić się w fundamentalne zasady rządzące materią. Jednym z kluczowych elementów tego zagadnienia jest budowa atomu. Zrozumienie budowy atomu jest niezbędne do wyjaśnienia właściwości chemicznych pierwiastków i tworzonych przez nie związków. Niniejszy artykuł ma na celu kompleksowe omówienie tego tematu, ze szczególnym uwzględnieniem aspektów istotnych dla uczniów szkół średnich przygotowujących się do matury z chemii na poziomie rozszerzonym. Przyjrzymy się zarówno teorii, jak i praktycznym przykładom, a także rozwiążemy kilka typowych zadań.
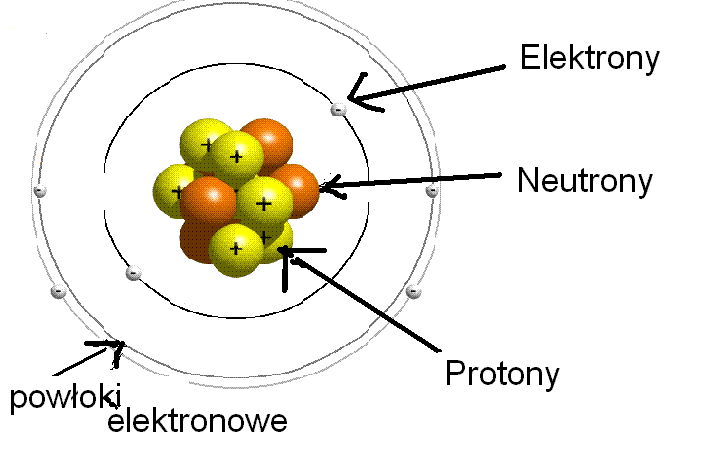
Podstawowe informacje o atomie
Atom, będący podstawową jednostką materii, składa się z trzech rodzajów cząstek subatomowych:
- Protony: Cząstki o ładunku dodatnim, znajdujące się w jądrze atomowym. Liczba protonów (liczba atomowa, Z) determinuje, jaki to pierwiastek.
- Neutrony: Cząstki obojętne elektrycznie, również znajdujące się w jądrze atomowym. Suma protonów i neutronów to liczba masowa, A.
- Elektrony: Cząstki o ładunku ujemnym, krążące wokół jądra. W atomie obojętnym elektrycznie liczba elektronów jest równa liczbie protonów.
Jądro atomowe, skupiające niemal całą masę atomu, jest bardzo małe w porównaniu z całym atomem. Elektrony poruszają się wokół jądra w określonych regionach przestrzeni, zwanych orbitalami atomowymi. Rozkład elektronów na orbitalach opisuje konfiguracja elektronowa.
Liczba atomowa (Z) i liczba masowa (A)
Liczbę atomową i liczbę masową zapisujemy po lewej stronie symbolu pierwiastka. Na przykład, symbol 2311Na oznacza atom sodu (Na) o liczbie atomowej 11 i liczbie masowej 23. Oznacza to, że w jądrze tego atomu znajduje się 11 protonów i 12 neutronów (23 - 11 = 12).
Pamiętaj, że liczba atomowa definiuje pierwiastek! Każdy atom o liczbie atomowej 11 to atom sodu.
Orbital atomowy i liczby kwantowe
Aby opisać stan elektronu w atomie, używamy czterech liczb kwantowych:
- Główna liczba kwantowa (n): Określa poziom energetyczny elektronu (n = 1, 2, 3,...). Im wyższa wartość n, tym wyższy poziom energetyczny i większa odległość od jądra. Poziomy energetyczne odpowiadają powłokom elektronowym (K, L, M, N...).
- Poboczna liczba kwantowa (l): Określa kształt orbitalu (l = 0, 1, 2, ..., n-1). Dla l = 0 mamy orbital s (kulisty), dla l = 1 - orbital p (kształt hantli), dla l = 2 - orbital d (bardziej skomplikowany kształt), dla l = 3 - orbital f.
- Magnetyczna liczba kwantowa (ml): Określa orientację przestrzenną orbitalu (ml = -l, -l+1, ..., 0, ..., l-1, l). Dla orbitalu p (l=1) mamy trzy możliwe orientacje (ml = -1, 0, 1), odpowiadające orbitalom px, py i pz.
- Spinowa liczba kwantowa (ms): Określa spin elektronu (ms = +1/2 lub -1/2). Elektron może mieć spin "w górę" lub "w dół".
Zgodnie z zakazem Pauliego, żaden elektron w atomie nie może mieć identycznego zestawu czterech liczb kwantowych. Oznacza to, że na każdym orbitalu mogą znajdować się maksymalnie dwa elektrony o przeciwnych spinach.
Konfiguracja elektronowa
Konfiguracja elektronowa to zapis rozkładu elektronów na poszczególnych powłokach i podpowłokach. Istnieją dwa sposoby zapisu konfiguracji elektronowej:
- Zapis pełny: np. 1s22s22p63s23p5 (dla chloru)
- Zapis skrócony: np. [Ne] 3s23p5 (dla chloru). W nawiasie kwadratowym umieszczamy konfigurację elektronową gazu szlachetnego poprzedzającego dany pierwiastek w układzie okresowym.
Kolejność zapełniania orbitali elektronami jest zgodna z regułą Madelunga (n+l). Orbital o niższej sumie n+l zapełniany jest jako pierwszy. Jeśli suma n+l jest taka sama dla dwóch orbitali, najpierw zapełniany jest orbital o niższej wartości n.
Izotopy i masa atomowa
Izotopy to atomy tego samego pierwiastka (mające tę samą liczbę protonów), ale różniące się liczbą neutronów. Na przykład, węgiel ma trzy naturalnie występujące izotopy: 12C (6 protonów i 6 neutronów), 13C (6 protonów i 7 neutronów) i 14C (6 protonów i 8 neutronów).
Masa atomowa pierwiastka to średnia ważona masa atomowa wszystkich jego naturalnie występujących izotopów, uwzględniająca ich procentowy udział. Masa atomowa jest wyrażana w jednostkach masy atomowej (u). Znajdziemy ją w układzie okresowym pierwiastków.
Obliczanie masy atomowej
Aby obliczyć masę atomową pierwiastka, należy znać masy atomowe jego izotopów oraz ich zawartość procentową. Wzór na obliczenie masy atomowej:
Matom = (Mizotop1 * %izotop1 + Mizotop2 * %izotop2 + ...)/100
Na przykład, chlor występuje w dwóch izotopach: 35Cl (masa atomowa 34,969 u, zawartość 75,77%) i 37Cl (masa atomowa 36,966 u, zawartość 24,23%). Masa atomowa chloru wynosi:
MCl = (34,969 u * 75,77% + 36,966 u * 24,23%) / 100 = 35,45 u
Zadania z budowy atomu
Teraz przejdźmy do praktyki i rozwiążmy kilka typowych zadań związanych z budową atomu, które mogą pojawić się na maturze z chemii rozszerzonej.
Zadanie 1: Określanie liczby protonów, neutronów i elektronów
Określ liczbę protonów, neutronów i elektronów w atomie 5626Fe.
Rozwiązanie:
- Liczba atomowa (Z) = 26, więc liczba protonów = 26.
- Liczba masowa (A) = 56, więc liczba neutronów = A - Z = 56 - 26 = 30.
- Ponieważ atom jest obojętny elektrycznie, liczba elektronów = liczba protonów = 26.
Zadanie 2: Zapisywanie konfiguracji elektronowej
Napisz pełną i skróconą konfigurację elektronową atomu siarki (S).
Rozwiązanie:
Siarka ma liczbę atomową 16. Pełna konfiguracja elektronowa:
1s22s22p63s23p4
Skrócona konfiguracja elektronowa:
[Ne] 3s23p4
Zadanie 3: Obliczanie masy atomowej
Bor występuje w dwóch izotopach: 10B (masa atomowa 10,013 u, zawartość 19,9%) i 11B (masa atomowa 11,009 u, zawartość 80,1%). Oblicz masę atomową boru.
Rozwiązanie:
MB = (10,013 u * 19,9% + 11,009 u * 80,1%) / 100 = 10,81 u
Zadanie 4: Liczby kwantowe
Podaj możliwe zestawy liczb kwantowych dla elektronu walencyjnego w atomie sodu (Na).
Rozwiązanie:
Sód ma konfigurację elektronową [Ne] 3s1. Elektron walencyjny znajduje się na orbitalu 3s.
Możliwe zestawy liczb kwantowych:
- n = 3, l = 0, ml = 0, ms = +1/2
- n = 3, l = 0, ml = 0, ms = -1/2
Praktyczne zastosowania wiedzy o budowie atomu
Wiedza o budowie atomu ma ogromne znaczenie w wielu dziedzinach nauki i technologii. Wykorzystywana jest m.in. w:
- Medycynie: Diagnostyka i terapia chorób z wykorzystaniem izotopów promieniotwórczych.
- Energetyce: Produkcja energii w elektrowniach jądrowych.
- Materiałoznawstwie: Projektowanie i synteza nowych materiałów o pożądanych właściwościach.
- Chemii analitycznej: Oznaczanie składu chemicznego substancji.
- Archeologii: Datowanie znalezisk archeologicznych metodą węgla radioaktywnego (14C).
Na przykład, w medycynie nuklearnej wykorzystuje się izotopy promieniotwórcze do obrazowania narządów i tkanek, a także do leczenia nowotworów. Izotop jodu-131 jest stosowany w leczeniu nadczynności tarczycy, a technet-99m jest szeroko stosowany w scyntygrafii, czyli obrazowaniu różnych narządów.
Podsumowanie i wskazówki do dalszej nauki
Zrozumienie budowy atomu jest fundamentalne dla opanowania chemii. Pamiętaj o kluczowych pojęciach, takich jak liczba atomowa, liczba masowa, orbital atomowy, liczby kwantowe i konfiguracja elektronowa. Regularne rozwiązywanie zadań i analizowanie przykładów pomoże Ci utrwalić wiedzę i przygotować się do matury z chemii na poziomie rozszerzonym.
Staraj się wizualizować struktury atomów i orbitali. Pomocne mogą być animacje i interaktywne modele dostępne w Internecie. Nie zapominaj również o powiązaniach między budową atomu a właściwościami chemicznymi pierwiastków. Zwróć uwagę na układ okresowy i jego związek z konfiguracją elektronową. Powodzenia w nauce!