Budowa Atomu Chemia Klasa 7
Witaj w fascynującym świecie budowy atomu! Ten artykuł, przeznaczony dla uczniów klasy 7, wprowadzi Cię w podstawowe pojęcia chemii, skupiając się na tym, z czego tak naprawdę zbudowana jest materia. Zrozumienie struktury atomu to klucz do poznania właściwości różnych substancji i reakcji chemicznych, które zachodzą wokół nas każdego dnia.
Podstawowe Składniki Atomu
Atom, choć niewyobrażalnie mały, nie jest najmniejszą cząstką materii. Składa się z jeszcze mniejszych elementów, zwanych cząstkami subatomowymi. Poznajmy je bliżej:
Protony
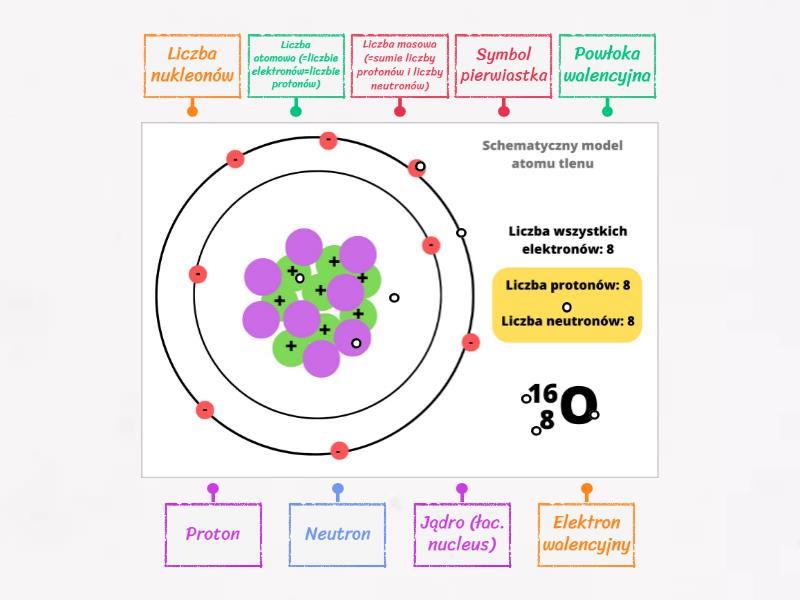
Protony to cząstki o ładunku dodatnim (+1). Znajdują się w jądrze atomowym i ich liczba determinuje, jaki to pierwiastek chemiczny. Na przykład, każdy atom z jednym protonem to atom wodoru, a atom z sześcioma protonami to atom węgla. Liczba protonów w atomie nazywana jest liczbą atomową (Z). Jest to fundamentalna cecha, która definiuje dany pierwiastek.
Pomyśl o tym jak o identyfikatorze pierwiastka. Zmiana liczby protonów zmienia pierwiastek! Protony, wraz z neutronami, tworzą jądro atomowe, które skupia prawie całą masę atomu.
Neutrony
Neutrony to cząstki obojętne elektrycznie (nie mają ładunku). Podobnie jak protony, znajdują się w jądrze atomowym. Ich obecność w jądrze wpływa na stabilność atomu. Atomy tego samego pierwiastka (czyli o tej samej liczbie protonów) mogą mieć różną liczbę neutronów. Takie atomy nazywamy izotopami.
Na przykład, węgiel ma dwa powszechne izotopy: węgiel-12 (6 protonów i 6 neutronów) oraz węgiel-14 (6 protonów i 8 neutronów). Węgiel-14 jest radioaktywny i wykorzystywany w datowaniu radiowęglowym, o którym więcej dowiesz się później.
Elektrony
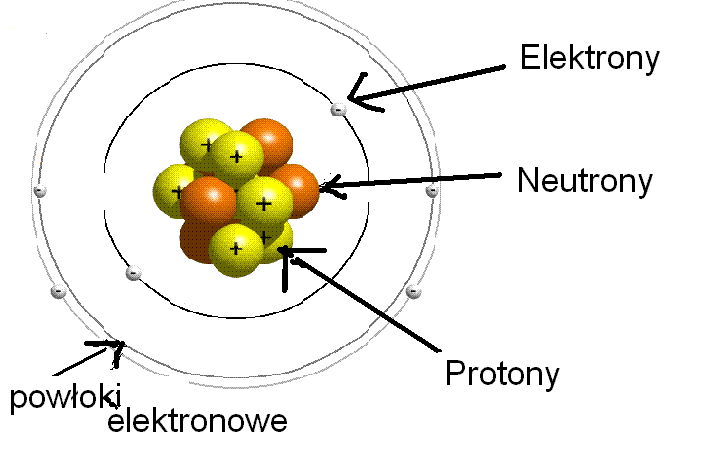
Elektrony to cząstki o ładunku ujemnym (-1). Są o wiele lżejsze niż protony i neutrony. Krążą wokół jądra atomowego, tworząc coś w rodzaju "chmury elektronowej". Elektrony poruszają się po określonych orbitalach, które odpowiadają różnym poziomom energii. Liczba elektronów w obojętnym atomie jest równa liczbie protonów.
Elektrony są odpowiedzialne za właściwości chemiczne atomu, czyli to, w jaki sposób atom reaguje z innymi atomami, tworząc wiązania chemiczne. To właśnie interakcje elektronów decydują o tym, czy dana substancja jest metalem, niemetalem, gazem czy cieczą.
Jądro Atomowe: Centrum Dowodzenia
Jądro atomowe, jak już wspomnieliśmy, skupia prawie całą masę atomu i składa się z protonów i neutronów. Siły, które utrzymują te cząstki razem w jądrze, są niezwykle silne. Nazywamy je siłami jądrowymi silnymi. Bez tych sił jądro atomowe rozpadłoby się ze względu na odpychanie się protonów (które mają ładunek dodatni).
Jądro jest bardzo małe w porównaniu z całym atomem. Gdyby atom był wielkości stadionu, jądro byłoby wielkości ziarnka grochu na środku boiska! Mimo swojej niewielkiej wielkości, jądro stanowi centrum kontroli i determinuje tożsamość pierwiastka.
Chmura Elektronowa i Orbitale
Elektrony nie krążą wokół jądra po określonych orbitach, jak planety wokół Słońca. Zamiast tego, poruszają się w przestrzeni wokół jądra w sposób bardziej skomplikowany, tworząc chmurę elektronową. Obszary tej chmury, w których prawdopodobieństwo znalezienia elektronu jest największe, nazywamy orbitalami.
Orbitale mają różne kształty i poziomy energii. Każdy orbital może pomieścić maksymalnie dwa elektrony o przeciwnych spinach (w uproszczeniu: jakby obracały się w przeciwnych kierunkach). Elektrony zajmują orbitale o najniższej energii jako pierwsze. Konfiguracja elektronowa atomu, czyli rozmieszczenie elektronów na poszczególnych orbitalach, jest kluczowa dla zrozumienia jego właściwości chemicznych.
Zasady rozmieszczania elektronów na orbitalach są regulowane przez szereg reguł, takich jak reguła Hunda i zakaz Pauliego. Zasady te pomagają przewidzieć, jak atomy będą reagować ze sobą, tworząc wiązania chemiczne.
Liczba Masowa (A)
Liczba masowa (A) to suma liczby protonów i neutronów w jądrze atomowym. Reprezentuje ona przybliżoną masę atomu, ponieważ masa elektronów jest pomijalnie mała w porównaniu z masą protonów i neutronów.
Różne izotopy tego samego pierwiastka mają różną liczbę masową, ponieważ różnią się liczbą neutronów. Na przykład, węgiel-12 ma liczbę masową 12 (6 protonów + 6 neutronów), a węgiel-14 ma liczbę masową 14 (6 protonów + 8 neutronów).
Układ Okresowy Pierwiastków
Układ Okresowy Pierwiastków to tabelaryczne przedstawienie wszystkich znanych pierwiastków chemicznych, uporządkowanych według rosnącej liczby atomowej (czyli liczby protonów w jądrze atomowym). Układ okresowy jest niezwykle użytecznym narzędziem, ponieważ pozwala przewidywać właściwości pierwiastków i ich związków chemicznych.
Pierwiastki w tej samej kolumnie (grupie) mają podobne właściwości chemiczne, ponieważ mają podobną konfigurację elektronową na zewnętrznej powłoce elektronowej (tzw. elektrony walencyjne). Liczba elektronów walencyjnych determinuje, w jaki sposób atom będzie reagował z innymi atomami.
Na przykład, pierwiastki z grupy 1 (metale alkaliczne) mają jeden elektron walencyjny i są bardzo reaktywne. Pierwiastki z grupy 17 (halogeny) mają siedem elektronów walencyjnych i również są bardzo reaktywne, ponieważ dążą do uzyskania ośmiu elektronów na zewnętrznej powłoce (tzw. oktet elektronowy).
Izotopy i Ich Zastosowania
Jak już wspomnieliśmy, izotopy to atomy tego samego pierwiastka, które mają różną liczbę neutronów w jądrze atomowym. Niektóre izotopy są stabilne, a inne są radioaktywne, co oznacza, że ich jądra samorzutnie się rozpadają, emitując promieniowanie.
Izotopy mają wiele zastosowań w różnych dziedzinach nauki i technologii. Oto kilka przykładów:
- Datowanie radiowęglowe: Izotop węgla-14 jest wykorzystywany do określania wieku materiałów organicznych (np. szczątków roślin i zwierząt) na podstawie pomiaru zawartości węgla-14.
- Medycyna: Radioaktywne izotopy są wykorzystywane w diagnostyce (np. do obrazowania narządów) i terapii (np. do leczenia raka).
- Przemysł: Izotopy są wykorzystywane do śledzenia przepływu cieczy i gazów w rurociągach, do badania zużycia materiałów oraz do sterylizacji sprzętu medycznego.
- Energetyka: Izotop uranu-235 jest wykorzystywany w elektrowniach jądrowych jako paliwo.
Reakcje Chemiczne i Budowa Atomu
Budowa atomu ma bezpośredni wpływ na sposób, w jaki atomy reagują ze sobą podczas reakcji chemicznych. Podczas reakcji chemicznych atomy łączą się ze sobą, tworząc wiązania chemiczne, które utrzymują je razem w cząsteczkach i związkach chemicznych.
Rodzaj wiązania chemicznego (np. jonowe, kowalencyjne, metaliczne) zależy od elektroujemności atomów, czyli ich zdolności do przyciągania elektronów. Różnica w elektroujemności między dwoma atomami decyduje o polarności wiązania chemicznego.
Na przykład, w cząsteczce wody (H2O) tlen jest bardziej elektroujemny niż wodór, co oznacza, że tlen przyciąga do siebie elektrony bardziej niż wodór. W rezultacie, cząsteczka wody jest polarna, co oznacza, że ma biegun dodatni (strona wodoru) i biegun ujemny (strona tlenu). Polarność wody jest odpowiedzialna za wiele jej unikalnych właściwości, takich jak zdolność do rozpuszczania wielu substancji i wysokie napięcie powierzchniowe.
Podsumowanie
Zrozumienie budowy atomu to fundament chemii. Mamy nadzieję, że ten artykuł pomógł Ci zrozumieć podstawowe pojęcia, takie jak: protony, neutrony, elektrony, jądro atomowe, orbitale, liczba atomowa, liczba masowa i izotopy. Pamiętaj, że chemia to nauka eksperymentalna, więc zachęcamy Cię do dalszego zgłębiania wiedzy poprzez wykonywanie prostych doświadczeń i obserwowanie otaczającego Cię świata.
Teraz, gdy znasz już podstawy budowy atomu, spróbuj odpowiedzieć na następujące pytania:
- Co to jest liczba atomowa i co ona oznacza?
- Czym różnią się izotopy?
- Jak rozmieszczone są elektrony w atomie?
- Jak budowa atomu wpływa na właściwości chemiczne substancji?
Powodzenia w dalszej nauce chemii!
![Budowa Atomu Chemia Klasa 7 Chemia klasa 7 [Lekcja 16 - Budowa atomu - nukleony i elektrony] - YouTube](https://i.ytimg.com/vi/not4NAhSezg/maxresdefault.jpg)