Budowa Atomu Chemia Gimnazjum Zadania

Hej uczniowie! Nadchodzi sprawdzian z budowy atomu? Bez obaw! Razem przejdziemy przez ten temat krok po kroku. Pokażę Wam, że chemia wcale nie musi być straszna, a wręcz przeciwnie – może być fascynująca! Ten przewodnik pomoże Wam uporządkować wiedzę i poczuć się pewniej przed testem. Gotowi? Zaczynamy!
Podstawowe informacje: Czym jest atom?
Na początek – fundament. Atom to podstawowy składnik materii, który zachowuje właściwości chemiczne danego pierwiastka. Wyobraźcie sobie, że macie LEGO. Atom to taki pojedynczy klocek, który buduje wszystko dookoła. Każdy pierwiastek (np. wodór, tlen, węgiel) ma swoje unikalne atomy.
No dobrze, ale z czego składa się ten atom?
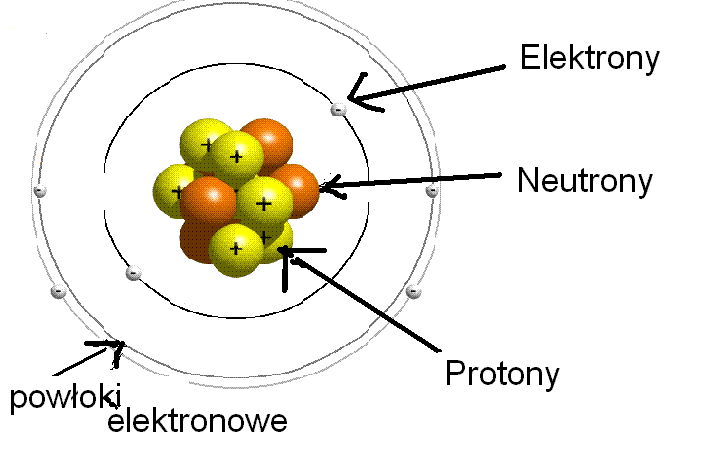
Skład atomu: Trzej muszkieterowie
Atom składa się z trzech podstawowych cząstek subatomowych:
- Protony (p+): Znajdują się w jądrze atomowym i mają ładunek dodatni (+1). Ilość protonów w jądrze określa liczbę atomową (Z), która jest charakterystyczna dla danego pierwiastka. To taki numer identyfikacyjny atomu!
- Neutrony (n0): Również znajdują się w jądrze atomowym, ale są elektrycznie obojętne (nie mają ładunku). Razem z protonami tworzą masę atomową.
- Elektrony (e-): Krążą wokół jądra po tzw. orbitalach (czasami też mówi się o powłokach elektronowych). Mają ładunek ujemny (-1).
Pamiętajcie: Protony i neutrony tworzą jądro atomowe, które jest bardzo małe, ale skupia prawie całą masę atomu. Elektrony są znacznie lżejsze i krążą wokół jądra w ogromnej przestrzeni. Trochę jak słońce i planety!
Liczba atomowa (Z) mówi nam ile protonów znajduje się w jądrze danego atomu. Na przykład, atom węgla (C) ma liczbę atomową 6, co oznacza, że ma 6 protonów. Liczba atomowa jest kluczowa do identyfikacji pierwiastka i znajdziecie ją w układzie okresowym.
Liczba masowa (A) to suma liczby protonów i neutronów w jądrze atomowym. Mówi nam o masie atomu. Żeby obliczyć liczbę neutronów, wystarczy od liczby masowej odjąć liczbę atomową: A – Z = liczba neutronów.
Przykład: Atom sodu (Na) ma liczbę atomową 11 i liczbę masową 23. Ile ma protonów, neutronów i elektronów?
- Protony: 11 (bo liczba atomowa Z = 11)
- Neutrony: 23 – 11 = 12
- Elektrony: W atomie obojętnym liczba elektronów jest równa liczbie protonów, więc 11.
Jony: Kiedy atom traci lub zyskuje elektrony
Atom w stanie obojętnym ma tyle samo protonów (ładunek dodatni) co elektronów (ładunek ujemny). Co się stanie, jeśli atom straci lub zyska elektrony? Powstaje wtedy jon!
- Kation: Jon z ładunkiem dodatnim. Powstaje, gdy atom traci elektrony. Na przykład, Na+ (jon sodu) to atom sodu, który stracił jeden elektron.
- Anion: Jon z ładunkiem ujemnym. Powstaje, gdy atom zyskuje elektrony. Na przykład, Cl- (jon chlorkowy) to atom chloru, który zyskał jeden elektron.
Pamiętajcie: Tracąc elektrony, atom staje się dodatni (kation), a zyskując elektrony, staje się ujemny (anion).
Izotopy: Atomy tego samego pierwiastka, ale o różnej liczbie neutronów
Izotopy to atomy tego samego pierwiastka (czyli mające tę samą liczbę protonów), ale różniące się liczbą neutronów w jądrze. Oznacza to, że mają różną liczbę masową (A).
Przykład: Węgiel występuje w przyrodzie w postaci trzech izotopów: węgla-12 (12C), węgla-13 (13C) i węgla-14 (14C). Wszystkie te izotopy mają 6 protonów, ale różnią się liczbą neutronów (odpowiednio 6, 7 i 8 neutronów).
Niektóre izotopy są promieniotwórcze (np. węgiel-14), co oznacza, że ich jądra są niestabilne i ulegają rozpadowi, emitując promieniowanie. Promieniotwórczość ma zarówno zastosowania (np. w medycynie), jak i zagrożenia (np. w elektrowniach atomowych).
Powłoki elektronowe: Jak elektrony krążą wokół jądra?
Elektrony nie krążą wokół jądra w sposób przypadkowy. Układają się na tzw. powłokach elektronowych, które są ponumerowane od 1 (najbliższa jądra) do nieskończoności. Każda powłoka może pomieścić określoną liczbę elektronów. Maksymalną liczbę elektronów na danej powłoce obliczamy ze wzoru: 2n2, gdzie n to numer powłoki.
- Powłoka K (n=1): max 2 elektrony
- Powłoka L (n=2): max 8 elektronów
- Powłoka M (n=3): max 18 elektronów
- Powłoka N (n=4): max 32 elektrony
Elektrony walencyjne to elektrony znajdujące się na ostatniej powłoce danego atomu. Elektrony walencyjne decydują o właściwościach chemicznych pierwiastka i o tym, jak pierwiastek ten będzie reagował z innymi pierwiastkami. Atomy dążą do uzyskania 8 elektronów walencyjnych (oktet elektronowy) lub 2 elektronów (dublet elektronowy dla wodoru i helu) na ostatniej powłoce, co zapewnia im stabilność. Dlatego atomy oddają, przyjmują lub uwspólniają elektrony, tworząc wiązania chemiczne.
Jak narysować model atomu?
Narysuj jądro atomowe (możesz je oznaczyć kółkiem). W środku wpisz liczbę protonów (Z) i neutronów (A-Z). Następnie narysuj okręgi reprezentujące powłoki elektronowe. Na każdej powłoce narysuj odpowiednią liczbę elektronów (kropki lub krzyżyki). Upewnij się, że na każdej powłoce jest maksymalna liczba elektronów, zanim przejdziesz do następnej powłoki. Na koniec zaznacz elektrony walencyjne.
Zadania: Czas na ćwiczenia!
Teraz, kiedy już znacie teorię, czas na praktykę! Rozwiążcie kilka zadań, żeby utrwalić wiedzę.
Zadanie 1: Atom pewnego pierwiastka ma 17 protonów, 18 neutronów i 17 elektronów. Jaki to pierwiastek? Jaka jest jego liczba atomowa i liczba masowa?
Podpowiedź: Liczba atomowa = liczba protonów. Pierwiastek identyfikujemy po liczbie atomowej w układzie okresowym. Liczba masowa = liczba protonów + liczba neutronów.
Zadanie 2: Narysuj model atomu tlenu (O). Tlen ma liczbę atomową 8 i liczbę masową 16.
Podpowiedź: Ile ma protonów, neutronów i elektronów? Ile elektronów znajduje się na poszczególnych powłokach?
Zadanie 3: Co to jest jon? Podaj przykłady kationów i anionów.
Podpowiedź: Jon to atom, który stracił lub zyskał elektrony.
Podsumowanie: Najważniejsze informacje
Gratulacje! Przeszliście przez najważniejsze zagadnienia dotyczące budowy atomu. Pamiętajcie o tych kluczowych punktach:
- Atom to podstawowy składnik materii.
- Atom składa się z protonów, neutronów i elektronów.
- Liczba atomowa (Z) to liczba protonów w jądrze.
- Liczba masowa (A) to suma liczby protonów i neutronów w jądrze.
- Jony powstają, gdy atom traci (kation) lub zyskuje (anion) elektrony.
- Izotopy to atomy tego samego pierwiastka o różnej liczbie neutronów.
- Elektrony krążą wokół jądra po powłokach elektronowych.
- Elektrony walencyjne to elektrony na ostatniej powłoce.
Uczcie się regularnie, rozwiązujcie zadania i nie bójcie się pytać! Powodzenia na sprawdzianie! Pamiętajcie, chemia może być przygodą!