Budowa Atomu A Położenie Pierwiastka Chemicznego W Układzie Okresowym

Dobrze, posłuchajcie uważnie, bo to co powiem, to kwintesencja wiedzy o budowie atomu i jego miejscu w układzie okresowym.
Atom, wbrew pozorom, to nie jest niepodzielna kulka. To skomplikowany system, który rządzi się swoimi prawami. W samym centrum atomu znajduje się jądro atomowe. Jądro to zawiera dwa rodzaje cząstek: protony i neutrony. Protony mają ładunek dodatni, a neutrony są elektrycznie obojętne. Liczba protonów w jądrze atomowym decyduje o tym, jaki to pierwiastek chemiczny. To jest tzw. liczba atomowa (Z). Na przykład, atom wodoru ma jeden proton (Z=1), atom helu ma dwa protony (Z=2), a atom tlenu ma osiem protonów (Z=8). Liczba neutronów w jądrze atomowym może być różna dla tego samego pierwiastka. Atomy tego samego pierwiastka, które różnią się liczbą neutronów, nazywamy izotopami. Suma liczby protonów i neutronów w jądrze atomowym to liczba masowa (A).
Na przykład, węgiel-12 ma 6 protonów i 6 neutronów (A=12), a węgiel-14 ma 6 protonów i 8 neutronów (A=14). Oba to węgiel, ale różnią się masą. To, co istotne, to liczba protonów – ona definiuje pierwiastek.
Wokół jądra atomowego krążą elektrony. Elektrony mają ładunek ujemny i są znacznie lżejsze od protonów i neutronów. W atomie obojętnym elektrycznie liczba elektronów jest równa liczbie protonów. Elektrony nie krążą sobie ot tak wokół jądra. Zajmują określone orbitale atomowe, które tworzą powłoki elektronowe. Najbliższa jądra jest powłoka K (n=1), potem L (n=2), M (n=3) i tak dalej. Każda powłoka może pomieścić określoną liczbę elektronów, zgodnie z wzorem 2n², gdzie n to numer powłoki. Tak więc, powłoka K może pomieścić maksymalnie 2 elektrony, powłoka L – 8 elektronów, powłoka M – 18 elektronów i tak dalej.
Orbitale atomowe mają różne kształty i energie. W obrębie każdej powłoki znajdują się podpowłoki oznaczone literami s, p, d, f. Podpowłoka s ma kształt sferyczny i może pomieścić 2 elektrony. Podpowłoka p ma kształt hantli i może pomieścić 6 elektronów. Podpowłoka d ma bardziej skomplikowany kształt i może pomieścić 10 elektronów. Podpowłoka f jest jeszcze bardziej złożona i może pomieścić 14 elektronów. Elektrony zajmują orbitale w kolejności rosnącej energii, zgodnie z regułą Aufbau, która mówi, że elektrony najpierw zapełniają orbitale o najniższej energii.
Konfiguracja elektronowa atomu to zapis rozmieszczenia elektronów na poszczególnych powłokach i podpowłokach. Na przykład, konfiguracja elektronowa atomu wodoru to 1s¹, atomu helu to 1s², atomu litu to 1s²2s¹, a atomu tlenu to 1s²2s²2p⁴. Konfiguracja elektronowa decyduje o właściwościach chemicznych pierwiastka.
Układ okresowy pierwiastków
Położenie pierwiastka w układzie okresowym jest ściśle związane z jego budową atomową. Układ okresowy to uporządkowane zestawienie pierwiastków chemicznych, uszeregowanych według rosnącej liczby atomowej. Pierwiastki o podobnych właściwościach chemicznych są umieszczone w tej samej grupie (kolumna pionowa) lub okresie (wiersz poziomy).
Numer grupy mówi nam o liczbie elektronów walencyjnych, czyli elektronów znajdujących się na ostatniej powłoce. Elektrony walencyjne odgrywają kluczową rolę w tworzeniu wiązań chemicznych. Pierwiastki z tej samej grupy mają podobną liczbę elektronów walencyjnych, dlatego wykazują podobne właściwości chemiczne. Na przykład, pierwiastki z grupy 1 (litowce) mają jeden elektron walencyjny i łatwo oddają ten elektron, tworząc jony dodatnie o ładunku +1. Pierwiastki z grupy 17 (fluorowce) mają siedem elektronów walencyjnych i łatwo przyjmują jeden elektron, tworząc jony ujemne o ładunku -1.
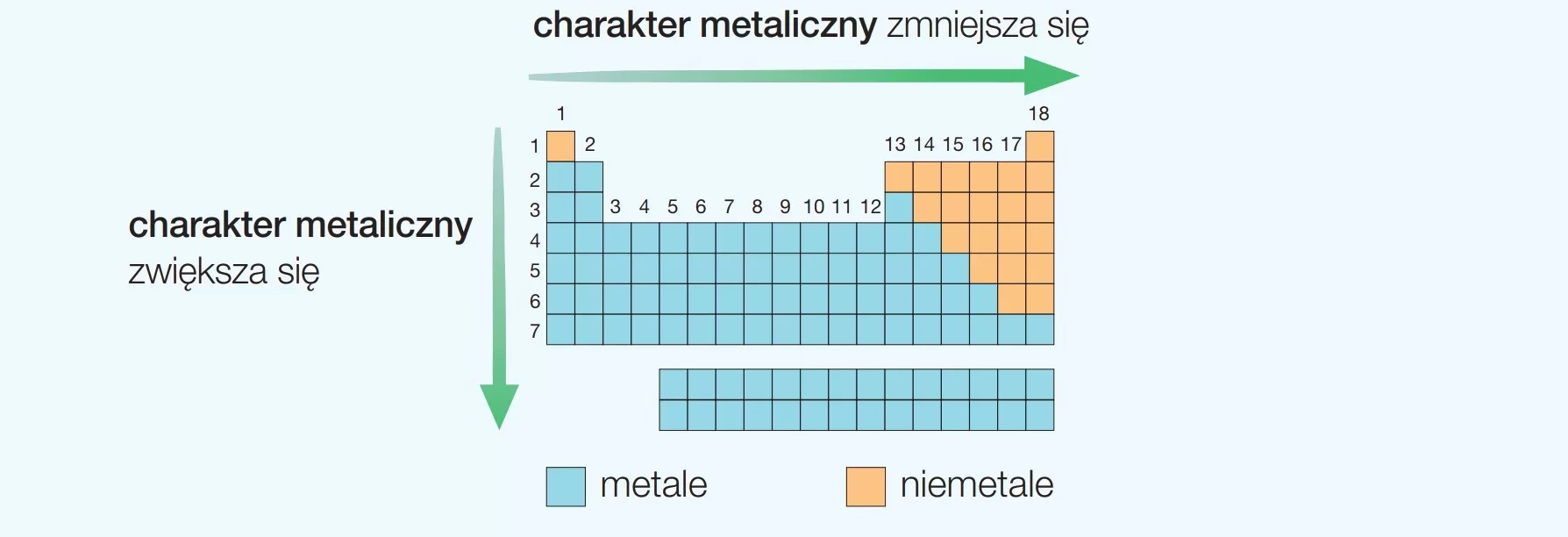
Numer okresu mówi nam o liczbie powłok elektronowych, które posiada atom danego pierwiastka. Na przykład, pierwiastki z okresu 1 mają jedną powłokę elektronową (K), pierwiastki z okresu 2 mają dwie powłoki elektronowe (K i L), a pierwiastki z okresu 3 mają trzy powłoki elektronowe (K, L i M). Właściwości pierwiastków zmieniają się okresowo wraz ze wzrostem liczby atomowej. W obrębie okresu obserwuje się zmiany charakteru metalicznego, elektroujemności, energii jonizacji i innych właściwości.
Podział na bloki w układzie okresowym (s, p, d, f) również wynika z konfiguracji elektronowej. Pierwiastki bloku s mają elektrony walencyjne na orbitalach s, pierwiastki bloku p mają elektrony walencyjne na orbitalach p, pierwiastki bloku d mają elektrony walencyjne na orbitalach d, a pierwiastki bloku f mają elektrony walencyjne na orbitalach f. Właściwości pierwiastków w poszczególnych blokach różnią się od siebie.
Na przykład, metale alkaliczne (grupa 1) i ziemnoalkaliczne (grupa 2) znajdują się w bloku s. Metale przejściowe znajdują się w bloku d. Półmetale i niemetale (z wyjątkiem wodoru i helu) znajdują się w bloku p. Lantanowce i aktynowce znajdują się w bloku f.
Podsumowanie zależności
Budowa atomu, a konkretnie liczba protonów (liczba atomowa) determinuje, jaki to pierwiastek i jego miejsce w układzie okresowym. Liczba elektronów walencyjnych, określona przez numer grupy, wpływa na właściwości chemiczne pierwiastka. Liczba powłok elektronowych, określona przez numer okresu, wpływa na wielkość atomu i jego energię. Konfiguracja elektronowa, a zwłaszcza elektrony walencyjne, decydują o tendencji do tworzenia wiązań chemicznych. Zależności te pozwalają przewidywać i wyjaśniać właściwości pierwiastków chemicznych na podstawie ich położenia w układzie okresowym.
Zapamiętajcie, układ okresowy to nie tylko tablica z pierwiastkami. To mapa, która ujawnia tajemnice budowy materii i jej właściwości. A zrozumienie budowy atomu to klucz do zrozumienia chemii.