Atomy Dążą Do Uzyskania Oktetu Elektronowego Czyli

Atom, fundament materii, jest fascynującą jednostką. Jego zachowanie, sposób interakcji z innymi atomami, decyduje o właściwościach makroskopowych substancji, które nas otaczają. Centralnym konceptem w zrozumieniu tych interakcji jest idea oktetu elektronowego, często powiązana z dążeniem atomów do osiągnięcia stanu stabilności. Skupmy się na tym dążeniu, jego naturze i konsekwencjach.
Atomy, z wyjątkiem wodoru i helu, które dążą do dubletu elektronowego, wykazują tendencję do otaczania się ośmioma elektronami walencyjnymi. Elektrony walencyjne to te znajdujące się na najbardziej zewnętrznej powłoce elektronowej atomu, uczestniczące bezpośrednio w tworzeniu wiązań chemicznych. Ta skłonność do oktetu wynika z faktu, że taka konfiguracja elektronowa jest energetycznie korzystna, co oznacza, że atom w takim stanie charakteryzuje się niższą energią i większą stabilnością.
Ale dlaczego akurat osiem elektronów? Odpowiedź leży w konfiguracji elektronowej gazów szlachetnych, takich jak neon, argon, krypton, ksenon i radon. Gazy te charakteryzują się wyjątkową biernością chemiczną, co oznacza, że rzadko reagują z innymi pierwiastkami. Ta bierność wynika właśnie z posiadania przez nie pełnej powłoki walencyjnej, czyli ośmiu elektronów (z wyjątkiem helu, który ma dwa). Atomy innych pierwiastków "zazdrośnie" obserwują tę stabilność i starają się ją naśladować.
Dążenie do oktetu elektronowego realizowane jest na różne sposoby, w zależności od właściwości chemicznych danego atomu. Atomy mogą tracić, zyskiwać lub dzielić się elektronami, aby osiągnąć upragniony stan. Mechanizmy te prowadzą do powstania różnych rodzajów wiązań chemicznych, które są odpowiedzialne za tworzenie niezliczonej liczby związków chemicznych, z których zbudowany jest cały wszechświat.
Wiązania Jonowe i Kowalencyjne: Dwie Drogi do Oktetu
Dwa podstawowe typy wiązań chemicznych, które wynikają z dążenia do oktetu, to wiązania jonowe i kowalencyjne. Wiązania jonowe powstają, gdy atomy o dużej różnicy elektroujemności, czyli zdolności do przyciągania elektronów, oddają sobie elektrony. Atom, który traci elektron, staje się jonem dodatnim (kationem), natomiast atom, który zyskuje elektron, staje się jonem ujemnym (anionem). Przyciąganie elektrostatyczne między jonami o przeciwnych znakach prowadzi do powstania wiązania jonowego. Klasycznym przykładem jest chlorek sodu (NaCl), czyli sól kuchenna. Atom sodu (Na) oddaje jeden elektron atomowi chloru (Cl), tworząc jony Na+ i Cl-. Dzięki temu oba jony uzyskują konfigurację elektronową najbliższego gazu szlachetnego (neon dla Na+ i argon dla Cl-) i są stabilne.
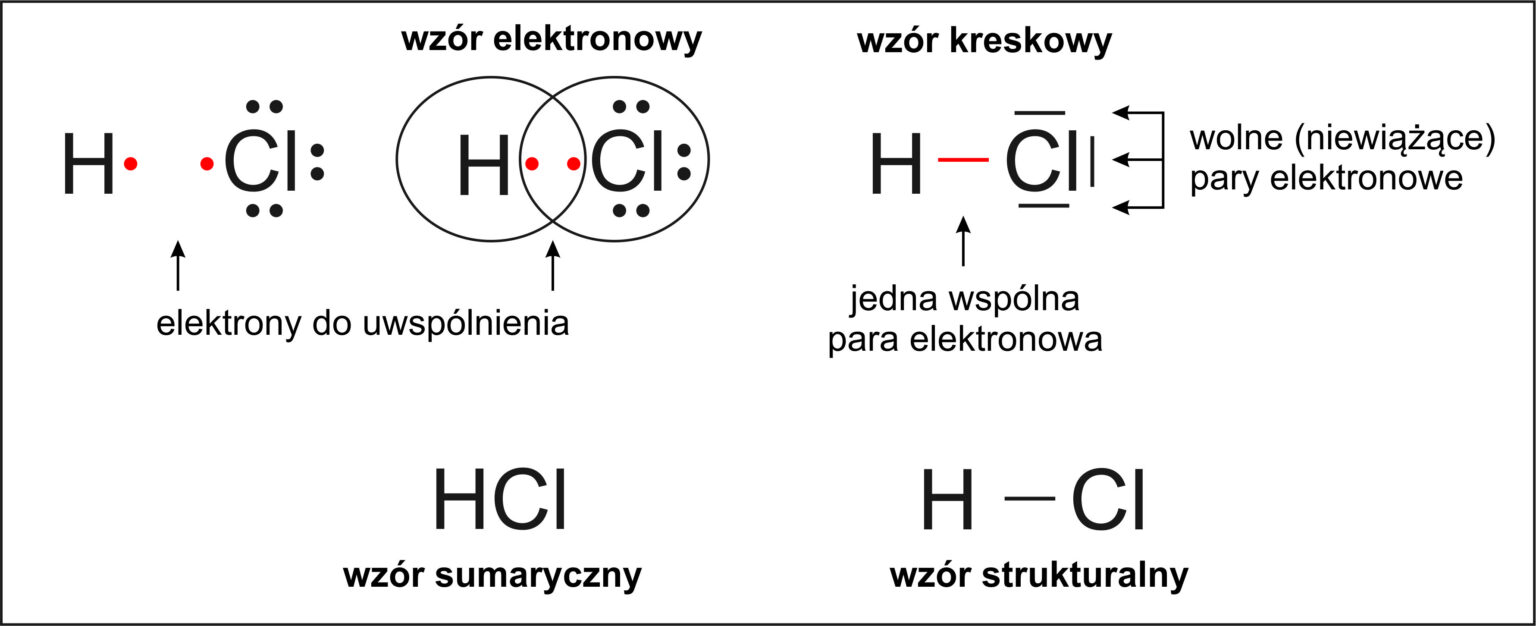
Wiązania kowalencyjne powstają, gdy atomy dzielą się elektronami, aby uzyskać oktet elektronowy. Ten rodzaj wiązania występuje zazwyczaj między atomami o zbliżonej elektroujemności. Dzielenie się elektronami pozwala obu atomom na "wspólne" posiadanie ośmiu elektronów na powłoce walencyjnej. Przykładem jest cząsteczka metanu (CH4). Atom węgla (C) ma cztery elektrony walencyjne, a każdy atom wodoru (H) ma jeden. Atom węgla dzieli się swoimi elektronami z czterema atomami wodoru, tworząc cztery wiązania kowalencyjne. W rezultacie atom węgla ma "wokół siebie" osiem elektronów (cztery od węgla i cztery od wodorów), a każdy atom wodoru ma dwa elektrony (dublet), co odpowiada konfiguracji helu.
Oprócz wiązań jonowych i kowalencyjnych istnieją również inne rodzaje wiązań, takie jak wiązania metaliczne i wiązania wodorowe, które również odgrywają istotną rolę w stabilizacji struktur chemicznych. Wiązania metaliczne występują w metalach i polegają na dzieleniu się elektronami walencyjnymi przez wiele atomów metalu, tworząc "morze elektronów", które zapewnia metalom charakterystyczne właściwości, takie jak przewodnictwo elektryczne i cieplne. Wiązania wodorowe, choć słabsze od wiązań kowalencyjnych i jonowych, są niezwykle ważne w biologii i chemii wody. Powstają one między atomem wodoru związanym z silnie elektroujemnym atomem (takim jak tlen lub azot) a innym atomem elektroujemnym. Wiązania wodorowe są odpowiedzialne za niezwykłe właściwości wody, takie jak wysokie napięcie powierzchniowe i zdolność do rozpuszczania wielu substancji.
Dążenie do oktetu nie zawsze jest idealnie realizowane. Istnieją wyjątki od reguły oktetu, szczególnie w przypadku pierwiastków z trzeciego i dalszych okresów układu okresowego. Atomy tych pierwiastków mogą otaczać się więcej niż ośmioma elektronami, tworząc tzw. hiperwartościowe związki. Przykładem jest pięciofluorek fosforu (PF5), gdzie atom fosforu jest związany z pięcioma atomami fluoru i ma "wokół siebie" dziesięć elektronów. Wyjaśnienie tego zjawiska leży w dostępności orbitali d na powłoce walencyjnej atomów tych pierwiastków, które mogą uczestniczyć w tworzeniu wiązań.
Należy również pamiętać, że oktet elektronowy jest jedynie uproszczonym modelem, który dobrze sprawdza się w wielu przypadkach, ale nie zawsze idealnie opisuje rzeczywistość. Bardziej zaawansowane teorie chemiczne, takie jak teoria orbitali molekularnych, dostarczają pełniejszego obrazu wiązań chemicznych i elektronowej struktury cząsteczek. Niemniej jednak, koncepcja oktetu elektronowego pozostaje niezwykle użytecznym narzędziem w zrozumieniu podstawowych zasad chemii i przewidywaniu właściwości związków chemicznych.
Rozumienie dążenia atomów do uzyskania oktetu elektronowego pozwala nam na przewidywanie i wyjaśnianie wielu zjawisk chemicznych. Od przewidywania, czy dana substancja będzie tworzyć wiązania jonowe czy kowalencyjne, po projektowanie nowych materiałów o pożądanych właściwościach, koncept ten stanowi fundament współczesnej chemii. Dzięki niemu możemy zrozumieć, dlaczego woda jest płynna w temperaturze pokojowej, dlaczego diament jest twardy, a grafit miękki, i dlaczego niektóre substancje są reaktywne, a inne nie. Dążenie do oktetu, choć na pierwszy rzut oka może wydawać się prostą zasadą, kryje w sobie klucz do zrozumienia złożoności i różnorodności świata chemii.