Alkany Alkeny Alkiny Wzory Sumaryczne
Czy kiedykolwiek zastanawiałeś się, co kryje się za skomplikowanymi nazwami związków organicznych, które słyszałeś na lekcjach chemii? Alkany, alkeny, alkiny – brzmią enigmatycznie, prawda? Ale nie martw się! W tym artykule rozłożymy je na czynniki pierwsze, wyjaśniając ich budowę, właściwości i wzory sumaryczne w sposób przystępny i zrozumiały. Zamiast czuć się zagubionym, zyskasz pewność, że rozumiesz podstawowe pojęcia chemii organicznej.
Wprowadzenie do węglowodorów: Podział i podstawowe różnice
Węglowodory, jak sama nazwa wskazuje, to związki organiczne zbudowane wyłącznie z atomów węgla (C) i wodoru (H). Stanowią one fundament chemii organicznej i występują w niezliczonych formach, od prostych gazów po złożone polimery. Podstawowy podział węglowodorów opiera się na typie wiązań między atomami węgla:
- Alkany: Zawierają wyłącznie pojedyncze wiązania węgiel-węgiel (C-C).
- Alkeny: Zawierają co najmniej jedno podwójne wiązanie węgiel-węgiel (C=C).
- Alkiny: Zawierają co najmniej jedno potrójne wiązanie węgiel-węgiel (C≡C).
Ta różnica w typie wiązań ma fundamentalny wpływ na właściwości chemiczne i fizyczne tych związków. Zrozumienie tych różnic to klucz do opanowania podstaw chemii organicznej.
Alkany: Królowie nasyconych węglowodorów
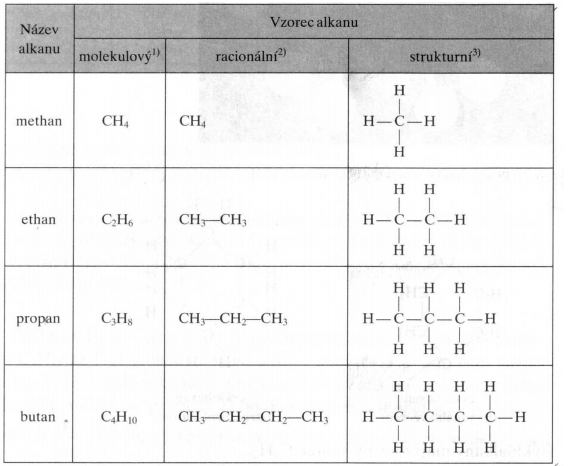
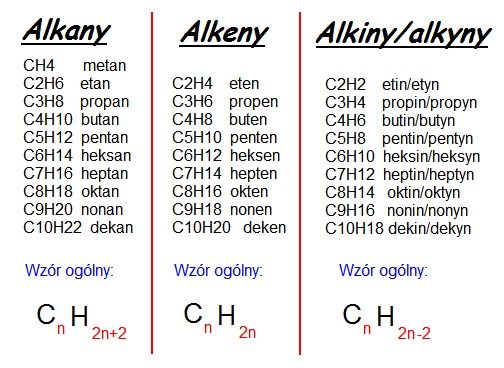
Alkany to nasycone węglowodory, co oznacza, że każdy atom węgla w cząsteczce jest związany z maksymalną możliwą liczbą atomów wodoru. Są to najprostsze i najmniej reaktywne związki organiczne. Ich wzór ogólny to CnH2n+2, gdzie 'n' oznacza liczbę atomów węgla.
Przykłady alkanów:
- Metan (CH4): Najprostszy alkan, główny składnik gazu ziemnego.
- Etan (C2H6): Stosowany jako paliwo i surowiec w przemyśle chemicznym.
- Propan (C3H8): Składnik gazu LPG, używany w kuchenkach i ogrzewaniu.
- Butan (C4H10): Również składnik gazu LPG, stosowany w zapalniczkach.
Właściwości alkanów:
- Niska reaktywność chemiczna (są stosunkowo obojętne).
- Wraz ze wzrostem liczby atomów węgla rośnie temperatura wrzenia i topnienia.
- Są nierozpuszczalne w wodzie.
- Dobrze rozpuszczają się w rozpuszczalnikach organicznych.
Alkany stanowią podstawę wielu paliw i są wykorzystywane w przemyśle petrochemicznym do produkcji tworzyw sztucznych, smarów i innych produktów.
Alkeny: Węglowodory z podwójnym charakterem
Alkeny to nienasycone węglowodory zawierające co najmniej jedno podwójne wiązanie węgiel-węgiel (C=C). Obecność tego wiązania sprawia, że alkeny są bardziej reaktywne niż alkany. Ich wzór ogólny to CnH2n.
Przykłady alkenów:
- Eten (C2H4), inaczej etylen: Ważny surowiec w przemyśle chemicznym, używany do produkcji polietylenu (PE).
- Propen (C3H6), inaczej propylen: Używany do produkcji polipropylenu (PP).
- Buten (C4H8): Izomer butenu, 1-buten, jest używany do produkcji kauczuku syntetycznego.
Właściwości alkenów:
- Wyższa reaktywność niż alkany ze względu na obecność wiązania podwójnego.
- Ulegają reakcjom addycji (przyłączania).
- Stosowane jako surowce w syntezie organicznej.
- Podobnie jak alkany, ich temperatura wrzenia i topnienia rośnie wraz ze wzrostem liczby atomów węgla.
Alkeny są kluczowe w przemyśle chemicznym, służąc jako budulec do produkcji tworzyw sztucznych, rozpuszczalników i wielu innych produktów. Etylen, na przykład, jest jednym z najważniejszych związków organicznych produkowanych na skalę przemysłową.
Alkiny: Mistrzowie potrójnej siły
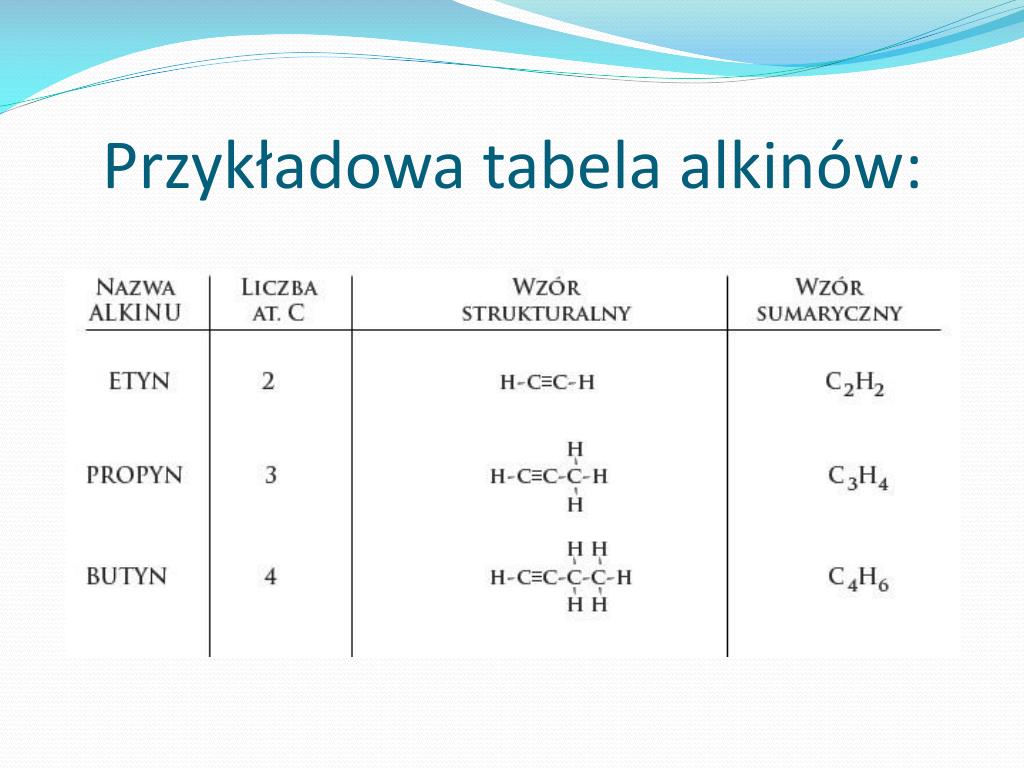
Alkiny to nienasycone węglowodory zawierające co najmniej jedno potrójne wiązanie węgiel-węgiel (C≡C). Są to jeszcze bardziej reaktywne związki niż alkeny ze względu na obecność dwóch wiązań π w potrójnym wiązaniu. Ich wzór ogólny to CnH2n-2.
Przykłady alkinów:
- Etyn (C2H2), inaczej acetylen: Używany w palnikach acetylenowo-tlenowych do spawania i cięcia metali.
- Propyn (C3H4): Wykorzystywany w syntezie organicznej.
Właściwości alkinów:
- Bardzo wysoka reaktywność chemiczna ze względu na obecność wiązania potrójnego.
- Ulegają reakcjom addycji (przyłączania) z większą łatwością niż alkeny.
- Acetylen jest gazem wybuchowym.
- Podobnie jak alkany i alkeny, ich temperatura wrzenia i topnienia rośnie wraz ze wzrostem liczby atomów węgla.
Alkiny, a zwłaszcza acetylen, mają szerokie zastosowanie w przemyśle, od spawania metali po syntezę zaawansowanych związków organicznych. Potrójne wiązanie stanowi "centrum reakcji", które można wykorzystać do tworzenia bardziej złożonych struktur molekularnych. Acetylen jest przykładem alkinu, który mimo swojej niebezpiecznej natury, jest niezastąpiony w wielu procesach przemysłowych.
Wzory sumaryczne: Klucz do identyfikacji węglowodorów
Wzór sumaryczny informuje nas o liczbie atomów każdego pierwiastka w cząsteczce związku. Pozwala to na szybkie rozpoznanie, czy dany związek jest alkanem, alkenem czy alkinem, a także na obliczenie masy molowej związku.
Jak korzystać ze wzorów ogólnych:
- Alkany (CnH2n+2): Jeśli masz alkan z 5 atomami węgla (n=5), jego wzór sumaryczny to C5H(2*5)+2 = C5H12.
- Alkeny (CnH2n): Dla alkenu z 6 atomami węgla (n=6), wzór sumaryczny to C6H(2*6) = C6H12.
- Alkiny (CnH2n-2): Dla alkinu z 4 atomami węgla (n=4), wzór sumaryczny to C4H(2*4)-2 = C4H6.
Pamiętaj, że wzór sumaryczny to tylko podstawowa informacja. Nie mówi nam o strukturze cząsteczki, czyli o tym, jak atomy są połączone ze sobą. Do tego służą wzory strukturalne i półstrukturalne.
Podsumowanie i wnioski
Zrozumienie różnic między alkanami, alkenami i alkinami, a także umiejętność korzystania ze wzorów sumarycznych, to fundament chemii organicznej. Alkany są nasycone i stosunkowo niereaktywne, alkeny zawierają jedno wiązanie podwójne i są bardziej reaktywne, a alkiny zawierają jedno wiązanie potrójne i są najbardziej reaktywne. Wzory sumaryczne pozwalają na szybką identyfikację rodzaju węglowodoru. Wiedza ta otwiera drzwi do zrozumienia bardziej zaawansowanych zagadnień chemii organicznej i jej zastosowań w życiu codziennym.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć podstawowe pojęcia związane z alkanami, alkenami i alkinami. Pamiętaj, że chemia to nauka oparta na zrozumieniu i praktyce. Kontynuuj naukę, rozwiązuj zadania i eksperymentuj, a z pewnością osiągniesz sukces!