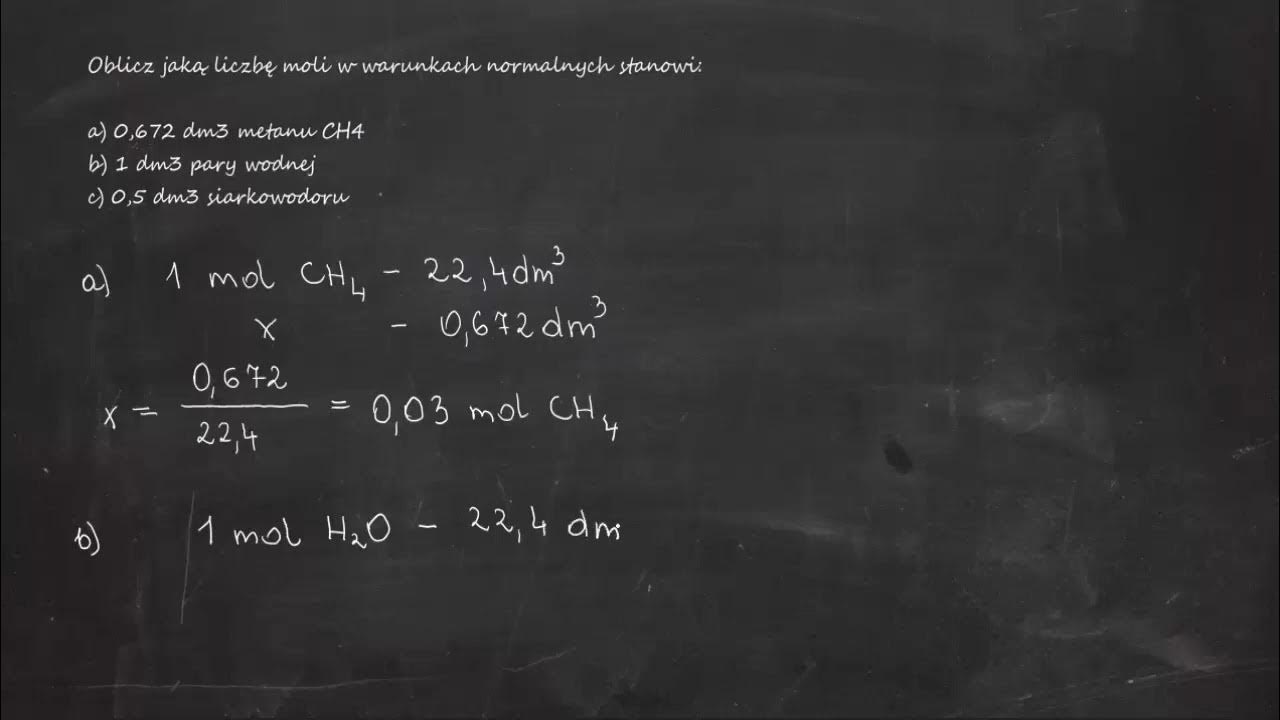500 Dm3 Amoniaku Odmierzonego W Warunkach Normalnych

Amoniak, NH3, związek o charakterystycznym, ostrym zapachu, od dawna zajmuje ważne miejsce w chemii i przemyśle. Jego wszechstronność sprawia, że jest wykorzystywany w szerokim spektrum zastosowań, od produkcji nawozów sztucznych po syntezę leków i materiałów wybuchowych. Rozważmy sytuację, w której dysponujemy 500 dm3 amoniaku odmierzonego w warunkach normalnych. Co to właściwie oznacza? Jak tę informację możemy wykorzystać?
Warunki normalne definiowane są jako temperatura 0°C (273,15 K) i ciśnienie 1013,25 hPa (hektopaskali), czyli 101,325 kPa (kilopaskali). W takich warunkach jeden mol gazu zajmuje objętość bliską 22,4 dm3. Ta wartość, znana jako molowa objętość gazu, pozwala nam przeliczyć objętość amoniaku na ilość moli.
Dzieląc objętość amoniaku w warunkach normalnych (500 dm3) przez molową objętość gazu (22,4 dm3/mol), uzyskujemy liczbę moli amoniaku:
500 dm3 / 22,4 dm3/mol ≈ 22,32 mole NH3
Znając liczbę moli, możemy obliczyć masę amoniaku. Masa molowa amoniaku (NH3) wynosi około 17,03 g/mol (14,01 g/mol dla azotu + 3 * 1,01 g/mol dla wodoru). Mnożąc liczbę moli amoniaku przez jego masę molową, otrzymujemy masę amoniaku:
22,32 mole * 17,03 g/mol ≈ 379,91 g NH3
Czyli, 500 dm3 amoniaku odmierzonego w warunkach normalnych odpowiada około 379,91 gramom amoniaku.
Gęstość amoniaku w warunkach normalnych wynosi około 0,771 g/dm3. Mnożąc objętość amoniaku przez jego gęstość, otrzymamy przybliżoną masę:
500 dm3 * 0,771 g/dm3 ≈ 385,5 g NH3
Różnica między dwoma obliczonymi wartościami masy wynika z zaokrągleń i drobnych odchyleń rzeczywistych gazów od idealnego zachowania.
Majac tę ilość amoniaku, co możemy z tym zrobić? Amoniak jest silną zasadą, i w reakcji z kwasami tworzy sole amonowe. Możemy zobojętnić go kwasem, tworząc np. chlorek amonu, który ma wiele zastosowań w rolnictwie i przemyśle. Możemy również przeprowadzić syntezę innych związków chemicznych, wykorzystując atomy azotu obecne w amoniaku. Przykładowo, reakcja amoniaku z tlenem w obecności katalizatora platynowego prowadzi do powstania tlenku azotu(II), który jest prekursorem w produkcji kwasu azotowego.
Obliczenia Stechiometryczne z Amoniakiem
Amoniak, jako reagent, pozwala na przeprowadzenie wielu obliczeń stechiometrycznych. Przykładowo, załóżmy, że chcemy zsyntetyzować azotan amonu (NH4NO3), powszechnie stosowany jako nawóz. Reakcja przebiega następująco:
NH3 + HNO3 → NH4NO3
Wiemy, że mamy do dyspozycji 22,32 mole amoniaku. Zgodnie z równaniem reakcji, jeden mol amoniaku reaguje z jednym molem kwasu azotowego, dając jeden mol azotanu amonu. To oznacza, że z 22,32 moli amoniaku, teoretycznie, możemy otrzymać 22,32 mole azotanu amonu.
Aby obliczyć masę otrzymanego azotanu amonu, musimy znać jego masę molową. Masa molowa NH4NO3 wynosi około 80,04 g/mol (14,01 g/mol dla azotu + 4 * 1,01 g/mol dla wodoru + 14,01 g/mol dla azotu + 3 * 16,00 g/mol dla tlenu). Mnożąc liczbę moli azotanu amonu przez jego masę molową, otrzymujemy masę azotanu amonu:
22,32 mole * 80,04 g/mol ≈ 1786,5 g NH4NO3
Czyli, teoretycznie, z 500 dm3 amoniaku odmierzonego w warunkach normalnych, możemy otrzymać około 1786,5 gram azotanu amonu.
Warto pamiętać, że w rzeczywistości wydajność reakcji chemicznych rzadko wynosi 100%. Czynniki takie jak niedoskonałe mieszanie reagentów, utrata produktu podczas izolacji i oczyszczania, oraz obecność reakcji ubocznych mogą obniżyć wydajność. Dlatego w praktyce ilość otrzymanego azotanu amonu może być niższa niż 1786,5 gram.
Innym przykładem jest reakcja amoniaku z wodą, prowadząca do powstania wodorotlenku amonu (NH4OH), który jest zasadą:
NH3 + H2O ⇌ NH4+ + OH-
Równowaga tej reakcji jest przesunięta w lewo, co oznacza, że amoniak tylko częściowo dysocjuje w wodzie. Stopień dysocjacji zależy od stężenia amoniaku i temperatury.
Amoniak w przemyśle jest produkowany na skalę przemysłową, głównie metodą Habera-Boscha, która polega na bezpośredniej syntezie z azotu i wodoru w obecności katalizatora żelazowego pod wysokim ciśnieniem i w podwyższonej temperaturze. Proces ten jest niezwykle energochłonny, ale pozwala na masową produkcję amoniaku, który jest kluczowym surowcem w produkcji nawozów azotowych, stanowiących podstawę współczesnego rolnictwa.
Wykorzystanie amoniaku nie ogranicza się jedynie do syntezy nawozów i innych związków chemicznych. Jest on również stosowany w chłodnictwie jako czynnik chłodniczy, w przemyśle tekstylnym do barwienia tkanin, w produkcji tworzyw sztucznych i w wielu innych gałęziach przemysłu. Ze względu na swoje właściwości, amoniak jest substancją wymagającą ostrożnego obchodzenia się z nią. Jest drażniący dla dróg oddechowych i skóry, a w wysokich stężeniach może być toksyczny. Dlatego podczas pracy z amoniakiem należy stosować odpowiednie środki ochrony osobistej, takie jak maski i rękawice.
Wracając do naszych 500 dm3 amoniaku odmierzonego w warunkach normalnych, możemy tę ilość wykorzystać na wiele sposobów. Możemy przeprowadzić syntezę azotanu amonu, zobojętnić go kwasem, lub użyć go jako czynnika chłodniczego. Wybór zależy od naszych potrzeb i dostępnych zasobów. Wiedza o ilości amoniaku, przeliczona na mole i masę, pozwala nam na dokładne planowanie reakcji chemicznych i obliczanie ilości potrzebnych reagentów. To z kolei przekłada się na efektywne i bezpieczne prowadzenie procesów chemicznych.