1 Zasada Termodynamiki Definicja I Wzór
Witajcie, młodzi naukowcy! Dziś zanurzymy się w fascynujący świat termodynamiki, a konkretnie – w jej fundament, Pierwszą Zasadę. Ta zasada, choć na pierwszy rzut oka może wydawać się skomplikowana, jest w rzeczywistości bardzo intuicyjna i opisuje coś, co obserwujemy na co dzień.
Czym jest Termodynamika?
Zanim przejdziemy do samej zasady, ustalmy, czym w ogóle zajmuje się termodynamika. Najprościej mówiąc, termodynamika to dziedzina fizyki, która bada związki między ciepłem, pracą i energią. Wyobraźcie sobie silnik samochodu, który zamienia energię zawartą w paliwie (energię chemiczną) na ruch kół (pracę mechaniczną) i ciepło (które oddaje do otoczenia). Albo lodówkę, która usuwa ciepło z jej wnętrza, aby utrzymać niską temperaturę. To właśnie termodynamika opisuje te procesy i ustala prawa, które nimi rządzą.
Pierwsza Zasada Termodynamiki: Definicja i Wzór
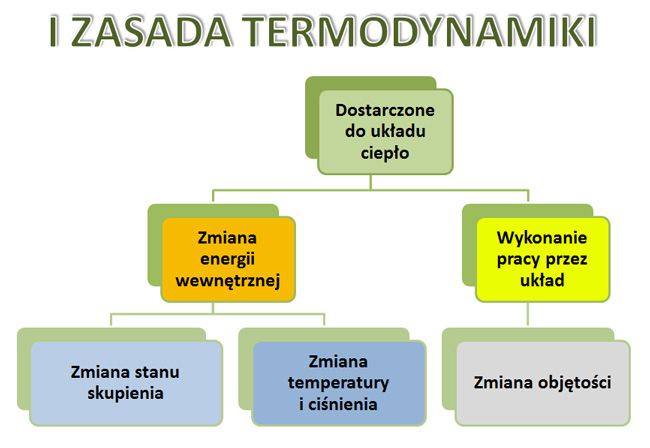
Pierwsza Zasada Termodynamiki, znana również jako zasada zachowania energii, mówi nam, że energia w układzie zamkniętym jest stała. Oznacza to, że energia nie może być ani stworzona, ani zniszczona, a jedynie przekształcona z jednej formy w drugą. To tak, jakbyśmy mieli skarbonkę, do której możemy wrzucać i z której możemy wyjmować pieniądze, ale ogólna ilość pieniędzy w całym systemie (skarbonka + to co trzymamy na zewnątrz, zanim wrzucimy) zawsze pozostaje taka sama.
Brzmi prosto, prawda? Ale jak to wyrazić matematycznie? Otóż, mamy na to specjalny wzór:
ΔU = Q - W
Gdzie:
- ΔU (delta U) – zmiana energii wewnętrznej układu. Energia wewnętrzna to suma energii kinetycznej (związanej z ruchem cząsteczek) i potencjalnej (związanej z oddziaływaniami między cząsteczkami) w układzie. Pomyślcie o niej jako o "wewnętrznym zapasie energii" układu.
- Q – ciepło dostarczone do układu. Ciepło to energia przekazywana na skutek różnicy temperatur. Jeśli ogrzewamy garnek z wodą, dostarczamy do niego ciepło.
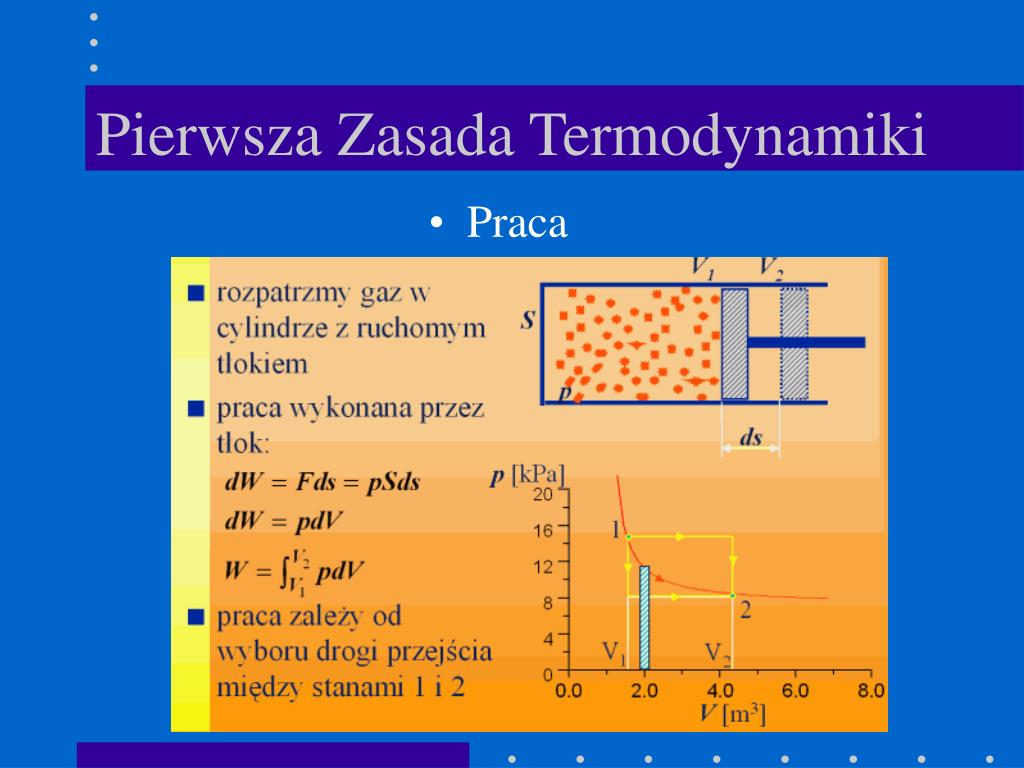
- W – praca wykonana przez układ. Praca to energia przekazywana przez siłę działającą na pewnej odległości. Jeśli gaz w cylindrze rozpręża się i przesuwa tłok, gaz wykonuje pracę.
Teraz spróbujmy to sobie wyobrazić. Wyobraźcie sobie balon napełniony powietrzem (nasz układ). Możemy ten balon ogrzać (dostarczyć ciepło Q). Wówczas energia wewnętrzna powietrza w balonie (ΔU) wzrośnie – cząsteczki zaczną poruszać się szybciej, a ciśnienie wewnątrz balonu wzrośnie. Możemy też pozwolić, aby balon się rozprężył, wykonując pracę (W) na otoczenie. W takim przypadku część energii wewnętrznej zostanie zużyta na wykonanie tej pracy.
Znak Konwencji: Klucz do zrozumienia wzoru
Ważna uwaga: pamiętajcie o znakach! Ciepło dostarczone do układu (Q) ma znak dodatni (+), a ciepło oddane przez układ ma znak ujemny (-). Praca wykonana przez układ (W) ma znak dodatni (+), a praca wykonana nad układem ma znak ujemny (-). To może brzmieć trochę myląco, ale pomyślcie o tym tak: jeśli coś "wchodzi" do układu, to dodajemy (+), a jeśli coś z niego "wychodzi", to odejmujemy (-).
Przykłady z życia codziennego
Zastanawiacie się, gdzie jeszcze możemy spotkać się z Pierwszą Zasadą Termodynamiki? Spójrzmy na kilka przykładów:
- Ogrzewanie wody w czajniku: Dostarczamy ciepło (Q) do wody, co powoduje wzrost jej energii wewnętrznej (ΔU). Woda staje się coraz gorętsza. Minimalna praca (W) jest wykonywana, głównie przez rozszerzanie się wody.
- Silnik spalinowy: Paliwo spala się w cylindrze, uwalniając ciepło (Q). Część tego ciepła zamieniana jest na pracę (W), która porusza tłok, a część jest oddawana do otoczenia. Zgodnie z Pierwszą Zasadą, energia zawarta w paliwie musi równać się sumie pracy i ciepła oddanego do otoczenia.
- Lodówka: Lodówka pobiera ciepło (Q) z jej wnętrza i oddaje je na zewnątrz. Aby to zrobić, musi wykonać pracę (W) – silnik lodówki spręża czynnik chłodniczy, co wymaga energii elektrycznej.
Wyobraźcie sobie również, że jeździcie na rowerze. Wasze ciało (układ) spala kalorie (energię chemiczną) z jedzenia. Część tej energii zamieniana jest na pracę (W), którą wykonujecie kręcąc pedałami, a część zamieniana jest na ciepło (Q), które oddajecie do otoczenia (dlatego pocicie się podczas wysiłku). Energetyczny bilans waszego ciała musi być zgodny z Pierwszą Zasadą Termodynamiki.
Podsumowanie
Pierwsza Zasada Termodynamiki to fundament fizyki, który mówi nam, że energia nie ginie, tylko przekształca się z jednej formy w drugą. Wzór ΔU = Q - W pozwala nam kwantyfikować te przekształcenia. Pamiętając o znakach konwencji, możemy analizować różne procesy termodynamiczne zachodzące wokół nas. Mam nadzieję, że dzięki tym przykładom i wizualizacjom, zrozumienie tej zasady stało się dla Was łatwiejsze!


.jpg)