Roztwory Sprawdzian Liceum Nowa Era

Witaj w artykule poświęconym zagadnieniu roztworów, szczególnie w kontekście sprawdzianów w liceum, bazujących na podręcznikach i materiałach wydawnictwa Nowa Era. Ten temat, choć może wydawać się trudny, jest fundamentalny dla zrozumienia chemii i ma szerokie zastosowanie w życiu codziennym. Przygotowując się do sprawdzianu, ważne jest, aby nie tylko znać definicje, ale również rozumieć mechanizmy zachodzące w roztworach i umieć rozwiązywać zadania obliczeniowe.
Podstawowe Pojęcia i Definicje
Zacznijmy od podstaw. Czym tak naprawdę jest roztwór?
Definicja Roztworu
Roztwór to jednorodna mieszanina dwóch lub więcej substancji. Składa się z rozpuszczalnika i substancji rozpuszczonej. Rozpuszczalnikiem jest substancja, która występuje w większej ilości lub w tym samym stanie skupienia co roztwór. Najczęściej rozpuszczalnikiem jest woda, wtedy mówimy o roztworze wodnym.
Przykład: Woda z solą. Woda jest rozpuszczalnikiem, a sól substancją rozpuszczoną. Mieszanina jest jednorodna, co oznacza, że w każdym punkcie ma takie same właściwości.
Rodzaje Roztworów
Roztwory można klasyfikować na różne sposoby, np. ze względu na stan skupienia:
- Roztwory ciekłe: Najpopularniejsze, np. roztwór soli w wodzie, ocet.
- Roztwory stałe: Stopione metale, np. brąz (mieszanina miedzi i cyny).
- Roztwory gazowe: Powietrze (mieszanina azotu, tlenu i innych gazów).
Inny podział dotyczy stężenia substancji rozpuszczonej:
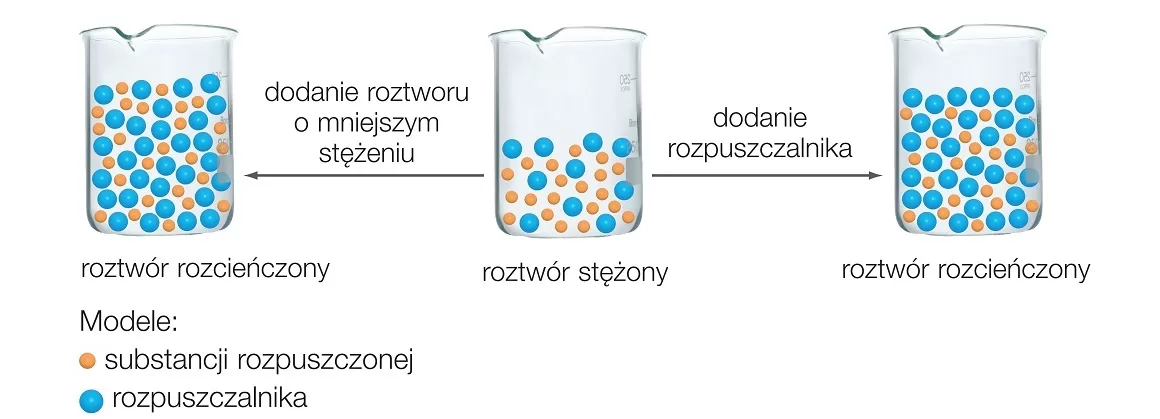
- Roztwór rozcieńczony: Zawiera małą ilość substancji rozpuszczonej.
- Roztwór stężony: Zawiera dużą ilość substancji rozpuszczonej.
- Roztwór nasycony: Roztwór, w którym w danej temperaturze nie można już rozpuścić więcej substancji.
- Roztwór nienasycony: Roztwór, w którym można rozpuścić jeszcze więcej substancji.
- Roztwór przesycony: Roztwór zawierający więcej substancji rozpuszczonej niż roztwór nasycony w danej temperaturze. Jest to stan nietrwały.
Stężenia Roztworów
Stężenie roztworu to ilość substancji rozpuszczonej w danej ilości roztworu lub rozpuszczalnika. Istnieje kilka sposobów wyrażania stężenia, a znajomość ich jest kluczowa do rozwiązywania zadań.
Stężenie Procentowe (Cp)
Stężenie procentowe (Cp) to liczba gramów substancji rozpuszczonej w 100 gramach roztworu. Wzór:
Cp = (ms / mr) * 100%
Gdzie:
- ms - masa substancji rozpuszczonej (w gramach)
- mr - masa roztworu (w gramach)
Przykład: Roztwór zawiera 20g cukru w 80g wody. Masa roztworu wynosi 100g (20g + 80g). Stężenie procentowe roztworu wynosi (20g / 100g) * 100% = 20%.
Stężenie Molowe (Cm)
Stężenie molowe (Cm) to liczba moli substancji rozpuszczonej w 1 litrze roztworu. Wzór:
Cm = n / V
Gdzie:
- n - liczba moli substancji rozpuszczonej
- V - objętość roztworu (w litrach)
Aby obliczyć liczbę moli (n), korzystamy ze wzoru:
n = m / M
Gdzie:
- m - masa substancji (w gramach)
- M - masa molowa substancji (w g/mol)
Przykład: Rozpuszczono 4g NaOH (wodorotlenku sodu) w wodzie, otrzymując 500 ml roztworu. Masa molowa NaOH wynosi około 40 g/mol. Zatem liczba moli NaOH wynosi 4g / 40 g/mol = 0,1 mol. Objętość roztworu w litrach wynosi 0,5 l. Stężenie molowe roztworu wynosi 0,1 mol / 0,5 l = 0,2 mol/l.
Ułamek Molowy (x)
Ułamek molowy (x) substancji w roztworze to stosunek liczby moli tej substancji do całkowitej liczby moli wszystkich składników roztworu. Wzór:
xA = nA / (nA + nB + ...)
Gdzie:
- nA - liczba moli substancji A
- nB - liczba moli substancji B
- ... - liczba moli pozostałych składników
Suma ułamków molowych wszystkich składników roztworu wynosi 1.
Przykład: Roztwór zawiera 1 mol etanolu i 9 moli wody. Ułamek molowy etanolu wynosi 1 / (1 + 9) = 0,1. Ułamek molowy wody wynosi 9 / (1 + 9) = 0,9.
Rozpuszczalność Substancji
Rozpuszczalność to maksymalna ilość substancji, która może się rozpuścić w danej ilości rozpuszczalnika w określonej temperaturze i ciśnieniu. Rozpuszczalność zależy od wielu czynników.
Czynniki Wpływające na Rozpuszczalność
- Rodzaj substancji rozpuszczanej i rozpuszczalnika: "Podobne rozpuszcza się w podobnym". Substancje polarne dobrze rozpuszczają się w polarnych rozpuszczalnikach (np. woda), a niepolarne w niepolarnych (np. benzen).
- Temperatura: Rozpuszczalność większości ciał stałych rośnie wraz ze wzrostem temperatury. Dla gazów zwykle maleje.
- Ciśnienie: Ma znaczący wpływ na rozpuszczalność gazów. Zgodnie z prawem Henry'ego, rozpuszczalność gazu w cieczy jest wprost proporcjonalna do ciśnienia parcjalnego tego gazu nad cieczą.
Krzywe rozpuszczalności to wykresy przedstawiające zależność rozpuszczalności od temperatury. Pozwalają one odczytać, ile gramów danej substancji można rozpuścić w 100g wody w danej temperaturze.
Obliczenia Stechiometryczne w Roztworach
Często na sprawdzianach pojawiają się zadania, w których trzeba połączyć wiedzę o roztworach z obliczeniami stechiometrycznymi. Należy pamiętać o przeliczaniu stężeń i mas substancji na mole oraz o odpowiednim bilansowaniu równań reakcji.
Przykład: Oblicz, ile gramów NaOH potrzeba do zobojętnienia 200 ml roztworu HCl o stężeniu 0,1 mol/l. 1. Obliczenie liczby moli HCl: n(HCl) = Cm * V = 0,1 mol/l * 0,2 l = 0,02 mol 2. Równanie reakcji: NaOH + HCl -> NaCl + H2O. Reakcja przebiega w stosunku molowym 1:1. 3. Liczba moli NaOH potrzebna do reakcji: n(NaOH) = n(HCl) = 0,02 mol 4. Obliczenie masy NaOH: m(NaOH) = n(NaOH) * M(NaOH) = 0,02 mol * 40 g/mol = 0,8 g Odpowiedź: Potrzeba 0,8 g NaOH.
Przykłady Zastosowań Roztworów w Życiu Codziennym
Roztwory otaczają nas na każdym kroku. Oto kilka przykładów:
- Napoje: Soki, herbata, kawa to roztwory różnych substancji w wodzie.
- Leki: Większość leków jest podawana w formie roztworów.
- Środki czystości: Płyny do mycia, proszki do prania to roztwory lub mieszaniny substancji czyszczących w wodzie.
- Kosmetyki: Kremy, balsamy, płyny do demakijażu to emulsje (rodzaj roztworów) lub mieszaniny.
- Roztwory fizjologiczne: Używane w medycynie do nawadniania organizmu (np. roztwór soli fizjologicznej).
- Przemysł: Procesy produkcyjne w wielu gałęziach przemysłu (chemicznym, spożywczym, farmaceutycznym) wykorzystują roztwory jako medium reakcyjne lub do rozdzielania substancji.
Praktyczne Porady Przed Sprawdzianem
- Powtórz definicje: Upewnij się, że rozumiesz podstawowe pojęcia, takie jak roztwór, rozpuszczalność, stężenie.
- Przerób zadania: Rozwiązuj jak najwięcej zadań obliczeniowych różnych typów. Wykorzystaj podręczniki Nowej Ery, zbiory zadań i arkusze maturalne.
- Zwróć uwagę na jednostki: Pamiętaj o prawidłowym przeliczaniu jednostek (np. gramy na kilogramy, mililitry na litry).
- Zrozum schematy: Postaraj się zrozumieć, co dzieje się na poziomie molekularnym podczas rozpuszczania substancji.
- Przejrzyj notatki: Przypomnij sobie najważniejsze informacje z lekcji.
- Poproś o pomoc: Jeśli masz trudności, nie wahaj się poprosić nauczyciela lub kolegów o wyjaśnienia.
Podsumowanie
Zagadnienie roztworów jest niezwykle ważne w chemii i ma liczne zastosowania praktyczne. Aby dobrze przygotować się do sprawdzianu w liceum, należy opanować definicje, wzory i umiejętność rozwiązywania zadań obliczeniowych. Pamiętaj o powtarzaniu materiału, rozwiązywaniu zadań i korzystaniu z dostępnych zasobów, takich jak podręczniki i zbiory zadań wydawnictwa Nowa Era. Powodzenia!
Teraz, kiedy już masz solidną wiedzę teoretyczną, przejdź do praktyki! Rozwiąż kilka przykładowych zadań ze swojego podręcznika Nowej Ery i sprawdź, czy wszystko rozumiesz. Jeśli napotkasz trudności, wróć do tego artykułu i przypomnij sobie najważniejsze informacje. Pamiętaj, że systematyczna praca i powtarzanie materiału to klucz do sukcesu!