Promień Atomowy W Układzie Okresowym
Zastanawiałeś się kiedyś, jak małe są atomy i dlaczego niektóre z nich są większe od innych? Kiedy przeglądamy układ okresowy pierwiastków, widzimy, że atomy wcale nie są takie same. Rozmiar atomu, a dokładniej promień atomowy, ma ogromny wpływ na właściwości chemiczne i fizyczne danego pierwiastka. Ale jak to dokładnie działa i dlaczego warto się tym przejmować? Wyjaśnimy to krok po kroku.
Co to jest Promień Atomowy?
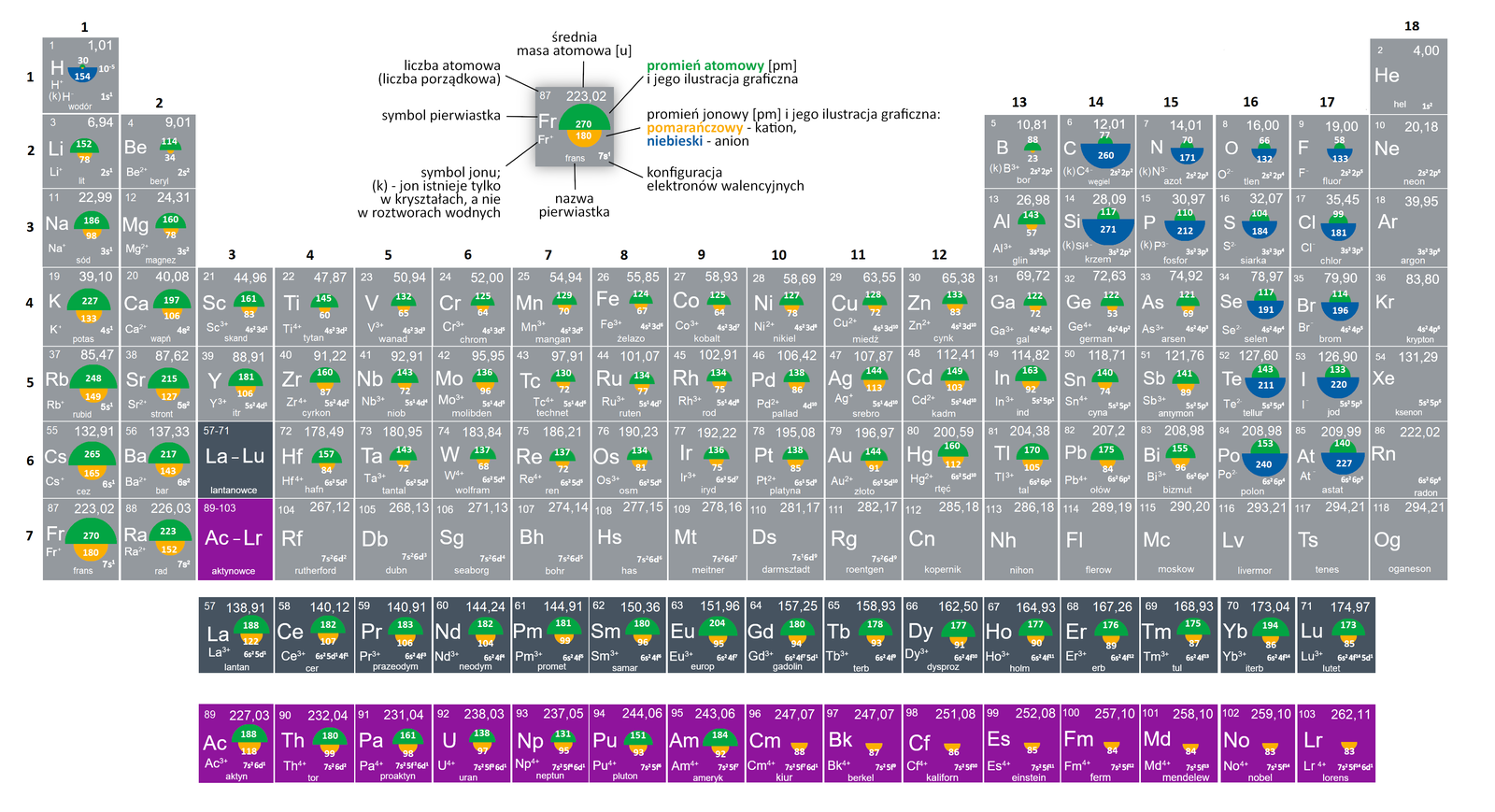
Promień atomowy to miara wielkości atomu. W gruncie rzeczy, to połowa odległości między jądrami dwóch sąsiednich atomów tego samego pierwiastka połączonych wiązaniem chemicznym. Brzmi skomplikowanie? Spróbujmy to uprościć:
Wyobraź sobie dwa identyczne kuleczki ściśnięte ze sobą. Odległość między środkami tych kuleczek, podzielona na dwa, to właśnie promień każdej z nich.
Problem polega na tym, że atom nie ma ostrej granicy. Elektrony nie krążą po ściśle określonych orbitach, ale tworzą chmurę elektronową wokół jądra. Dlatego mierzenie promienia atomowego nie jest takie proste i istnieje kilka różnych sposobów jego określania, w zależności od rodzaju wiązania chemicznego.
Różne Rodzaje Promieni Atomowych
- Promień kowalencyjny: Mierzony dla atomów połączonych wiązaniem kowalencyjnym (współdzielących elektrony).
- Promień metaliczny: Mierzony dla atomów w sieci krystalicznej metalu.
- Promień van der Waalsa: Mierzony jako połowa odległości między jądrami dwóch atomów, które nie są ze sobą związane chemicznie, ale zbliżone siłami van der Waalsa.
Każdy z tych promieni może dawać nieco inne wartości, ale ogólnie rzecz biorąc, dają one wgląd w względne rozmiary atomów.
Jak Promień Atomowy Zmienia się w Układzie Okresowym?
Teraz najważniejsze: jak promień atomowy zachowuje się, gdy poruszamy się po układzie okresowym? Istnieją wyraźne trendy, które warto znać.
Trendy w Grupie (Kolumnie)
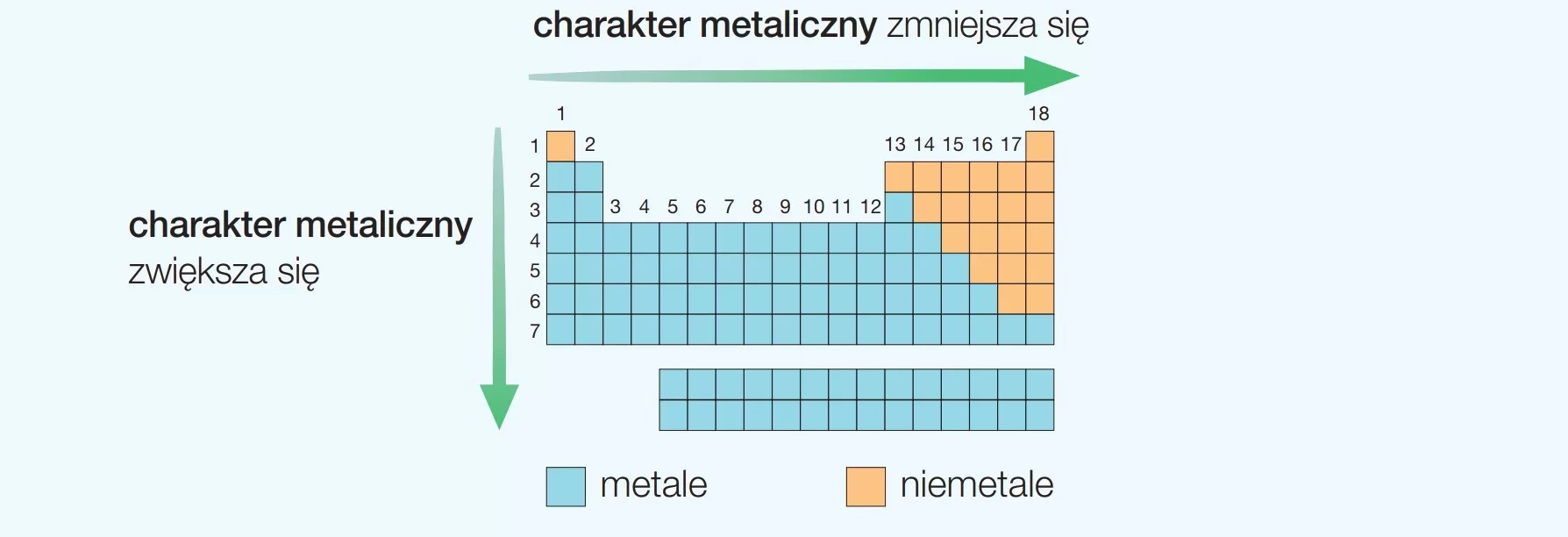
Idąc w dół grupy (od góry do dołu), promień atomowy ZAZWYCZAJ rośnie. Dlaczego? Ponieważ dodawane są kolejne powłoki elektronowe. Każda powłoka znajduje się dalej od jądra, co powoduje, że atom staje się większy.
Przykład: Lit (Li), sód (Na), potas (K), rubid (Rb), cez (Cs). Cez jest znacznie większy od litu, ponieważ ma znacznie więcej powłok elektronowych.
Trendy w Okresie (Rzędzie)
Idąc w prawo w okresie (od lewej do prawej), promień atomowy ZAZWYCZAJ maleje. To może wydawać się sprzeczne z intuicją, ale ma to swoje uzasadnienie.
Mimo że dodajemy kolejne elektrony do tej samej powłoki, dodajemy również protony do jądra. Zwiększona liczba protonów powoduje silniejsze przyciąganie elektronów do jądra, co "ściąga" powłokę elektronową bliżej i zmniejsza promień atomowy.
Przykład: Lit (Li), beryl (Be), bor (B), węgiel (C), azot (N), tlen (O), fluor (F), neon (Ne). Fluor jest znacznie mniejszy od litu.
Wyjątki od Reguły
Oczywiście, jak w każdej regule, istnieją wyjątki. Przejście od metali przejściowych do pierwiastków p-bloku (np. od cynku (Zn) do galu (Ga)) może czasami wykazywać mniej wyraźny spadek promienia atomowego. Jest to związane z efektami ekranowania elektronów d i f, które komplikują prosty model przyciągania jądra.
Dlaczego Promień Atomowy jest Ważny?
Może się wydawać, że rozmiar atomu to czysto akademicka ciekawostka, ale tak naprawdę ma to ogromne znaczenie w wielu dziedzinach:
- Reaktywność chemiczna: Im większy atom, tym słabiej elektrony walencyjne (te na zewnętrznej powłoce) są trzymane przez jądro. To sprawia, że atom jest bardziej skłonny do oddawania elektronów i reagowania z innymi substancjami. Na przykład, cez (Cs) jest bardzo reaktywny, podczas gdy lit (Li) jest mniej reaktywny.
- Właściwości fizyczne: Rozmiar atomu wpływa na gęstość, temperaturę topnienia i wrzenia oraz przewodnictwo elektryczne i cieplne.
- Kataliza: Wiele reakcji chemicznych jest katalizowanych przez metale przejściowe. Rozmiar atomów metalu katalizatora wpływa na to, jak dobrze absorbują i aktywują cząsteczki reagujące.
- Materiały: Właściwości mechaniczne materiałów, takie jak wytrzymałość i twardość, zależą od rozmiarów i ułożenia atomów.
- Biologia: Rozmiar i kształt atomów w cząsteczkach biologicznych, takich jak białka i DNA, determinują ich funkcje.
Realny przykład: Bateria litowo-jonowa. Lit jest używany ze względu na jego mały promień atomowy i niską masę atomową, co pozwala na gromadzenie dużej ilości energii w stosunkowo małej przestrzeni. Alternatywy, takie jak sód, mają większy promień, co sprawia, że baterie oparte na sodzie byłyby większe i cięższe przy podobnej pojemności.
Kontrargumenty i Wyzwania
Mimo że koncepcja promienia atomowego jest niezwykle użyteczna, ważne jest, aby pamiętać o jej ograniczeniach. Niektórzy krytycy argumentują, że przypisywanie atomom określonego rozmiaru jest nadmiernym uproszczeniem rzeczywistości kwantowej. Elektronów nie można traktować jak twardych kulek i chmura elektronowa nie ma ostrej granicy.
Ponadto, precyzyjny pomiar promienia atomowego jest trudny i zależy od metody pomiaru oraz rodzaju związku chemicznego. W praktyce używamy wartości empirycznych i bazujemy na trendach, a nie na absolutnych pomiarach.
Jednak pomimo tych wyzwań, koncepcja promienia atomowego pozostaje cennym narzędziem do zrozumienia i przewidywania właściwości pierwiastków i związków chemicznych.
Co możemy zrobić?
Zamiast postrzegać trendy w promieniach atomowych jako skomplikowany zestaw zasad do zapamiętania, spróbujmy zrozumieć podstawowe przyczyny tych trendów: przyciąganie jądra i efekty ekranowania elektronów. Pamiętaj, że układ okresowy jest potężnym narzędziem do przewidywania właściwości, ale ważne jest, aby być świadomym jego ograniczeń.
Możemy również:
- Używać interaktywnych układów okresowych online, które wizualizują trendy w promieniach atomowych.
- Porównywać rozmiary atomów różnych pierwiastków, aby lepiej zrozumieć różnice w ich właściwościach chemicznych.
- Rozważać, jak zmiana rozmiaru atomu wpływa na właściwości makroskopowe materiałów.
Rozwiązanie skupione na wiedzy: Edukacja chemiczna powinna kłaść nacisk na zrozumienie podstawowych zasad, a nie tylko na zapamiętywanie faktów. Uczniowie powinni być zachęcani do zadawania pytań i eksplorowania związków między strukturą atomową a właściwościami makroskopowymi.
Zatem, jak myślisz, w jaki sposób zrozumienie promienia atomowego może pomóc w projektowaniu nowych materiałów lub leków?